题目内容
18.CO2是引起“温室效应”的主要物质,节能减排,高效利用化石能源,控制CO2排放,探索CO的循环利用是保护环境,促进经济科持续发展的重要举措.(1)在一定温度下,向2L固定容积的密闭容器中通入2mol CO2,3mol H2,发生反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-490KI/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.
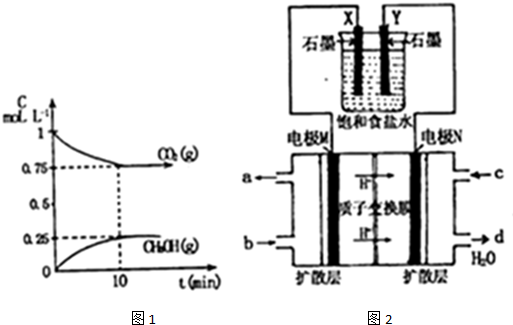
①能说明该反应已达到平衡状态的是A
A.CO2(g)体积分数在混合气体中保持不变
B.单位时间内有1.2mol H-H断裂,同时有0.8mol O-H键生成
C.混合气体的密度不随时间变化
D.当体系中c(H2O):c(CH3OH)=l:l,且保持不变
②下列措施能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是CD
A.升高温度 B.恒温恒容充入Hc(g) C.使H2O(g)变成H2O(l)
D.恒温恒容下,再充入2mol CO2,3mol H2
③计算该温度下此反应的平衡常数K=0.2;若使K=1应采取的措施是D
A.增大压强B.恒压加入一定量H2C.恒容通入CO2D.降低温度E.升高温度
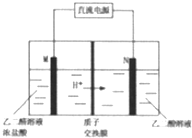
(2)如图2所示:用某甲醇燃料电池作电源电解饱和食盐水.
①写出电极N发生的反应式:O2+4e-+4H+=2H2O
②若食盐水体积为300Ml,电解过程溶液体积变化忽略不计,常温下测得PH=13时,理论上消耗甲醇质量为0.16g.
分析 (1)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,则根据反应,平衡向正反应方向移动即可;
③根据图象数据结合平衡常数K的计算公式进行计算,根据K仅与温度有关及反应为放热来判断改变条件;
(2)①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理,最后书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解.
解答 解:(1)①A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.单位时间内有1.2mol H-H断裂,同时有0.8mol O-H键生成,不能体现正逆反应,故不能说明达到平衡状态,故B错误;
C.密度=$\frac{m}{V}$,总质量一定,体积一定,故密度一定,故混合气体的密度不再发生改变不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比一直为1:1,不能说明达到平衡状态,故D错误;
故选A;
②要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,
A.升高温度,平衡逆向移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.恒温恒容下充入He(g),平衡不移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故B错误;
C.将H2O(g)从体系中分离,平衡正向移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C正确;
D.恒温恒容再充入2mol CO2和3mol H2,等效于开始加入4molCO2和6molH2,压强增大,平衡正向移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正确;
故选:CD;
③由图象数据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,则要使K=1,又反应放热所以降低温度使平衡向正反应方向移动,故答案为:0.20;D;
(2)①N区是质子流入的一极,应是原电池的正极,发生还原反应,电极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH-,pH值变为13时,pOH=1,C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH-,
可知 CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol×$\frac{1}{6}$mol=0.16g,
故答案为:0.16.
点评 本题考查了化学平衡的有关知识,电极反应式的书写等,综合性强,但难度不大,注意三段式应用和得失电子守恒原理.

 每课必练系列答案
每课必练系列答案| A. | AlCl3溶液中滴加浓氨水至过量:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| B. | MnO2与浓盐酸反应制取Cl2:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | 小苏打溶液中加入足量稀盐酸:HCO3-+H+=CO2↑+H2O | |
| D. | 电解饱和食盐水的阴极反应:2Cl--2e-=Cl2↑ |
| A. | SO2是该反应的催化剂 | B. | MFe2Ox是还原剂 | ||
| C. | X<Y | D. | SO2发生了置换反应 |
| A. | 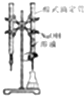 如图装置可用于已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. |  如图装置可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 | |
| C. | 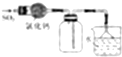 如图装置可用于收集SO2,并吸收多余的SO2 | |
| D. | 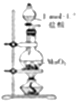 如图装置可用于制取少量Cl2 |
 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | N电极上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CH0+H2O | |
| B. | 若有2molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1mol | |
| C. | M电极上的电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl |
 始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式(线表示C-C键,端点、交点表示碳原子)如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式(线表示C-C键,端点、交点表示碳原子)如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R1=R2=-CH3,则其化学式为C12H16 | |
| C. | 始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的 | |
| D. | 若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种 |
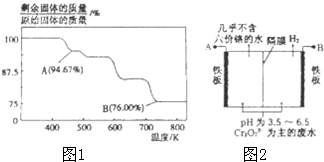 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.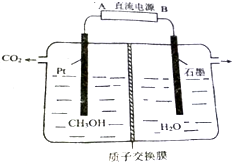 工业废水中的甲醇也可用电化学方法处理,原理如图所示.
工业废水中的甲醇也可用电化学方法处理,原理如图所示.