��Ŀ����
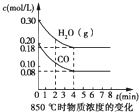
��1��850��ʱ����һ���Ϊ10L�ĺ����ܱ�������ͨ��һ������CO��g����H2O��g����CO��g����H2O��g����Ũ����ʱ��仯��������ͼ��ʾ������˵����ȷ����______������ţ���
A���ﵽƽ��ʱ�����������ʵ�����0.12mol
B���ﵽƽ��ʱ����Ӧ��ϵ���ջ�ų�49.44kJ����
C���ӵ�4min��ʼ����������ƽ����Է��������Ų��ٱ仯
D����6minʱ���������¶ȣ��÷�Ӧ�Ļ�ѧƽ�ⳣ�����С
��2��850��ʱ�������ݻ�Ϊ2L���ܱ�������ͬʱ����1.0mol CO��3.0mol H2O��g����1.0mol CO2��x mol H2��Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ�����������______��
��3��850��ʱ�������ݻ�Ϊ2L���ܱ�������ͬʱ����1.0mol CO��2.0mol H2O��g������ ��ƽ��ʱ��CO��ת������______��С�������1λ��Ч���֣���

B������1.2mol������ͨ�������·ų�������Ϊ41.2kJ��
| 1.2mol |
| 1mol |
C����ͼ��֪4minʱ����ƽ�⣬�淴Ӧ���У�����������������䣬�����ʵ�����С��ƽ����Է�����������ƽ��ʱ��������ƽ����Է����������仯����C��ȷ��
D���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ�����淴Ӧ�ƶ���ƽ�ⳣ����С����D��ȷ��
��ѡCD��
��2����ͼ��֪��ƽ��ʱCO��Ũ��Ϊ0.08mol/L����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����0.2 0.3 0 0
�仯��mol/L����0.12 0.12 0.12 0.12
�仯��mol/L����0.08 0.18 0.12 0.12
��ƽ�ⳣ��k=
| 0.12��0.12 |
| 0.08��0.18 |
ƽ��������Ӧ�����ƶ���Ũ����С��ƽ�ⳣ������
| 1��x |
| 1��3 |
�ʴ�Ϊ��x��3��
��3����ƽ��ʱ�μӷ�Ӧ��COΪymol����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol����1 2 0 0
�仯��mol����y y y y
�仯��mol����1-y 2-y y y
��Ӧǰ������������䣬��
| y��y |
| (1-y)��(2-y) |
| 2 |
| 3 |
��CO��ת����Ϊ
| ||
| 1mol |
�ʴ�Ϊ��66.7%��

��һ�̶��ݻ����ܱ������н��������·�Ӧ��
CO2(g) + H2(g)  CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2) ���жϸ÷�Ӧ�Ƿ��Ѿ��ﵽ��ѧƽ��״̬���ǣ�
����������ѹǿ���䡡�� �£����������COŨ�Ȳ���
�ã�v(H2)��= v(H2O)�桡�� D��c(CO2) = c(CO)��
��3��ij�о�С�����÷�Ӧ��CO(g)+H2O(g)
 H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ����4���罫H2��CO2��4:1������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g) + 2O2(g)
 CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol H2(g) + 1/2O2(g)
 H2O��1�� ��H2����285.8 kJ/mol
H2O��1�� ��H2����285.8 kJ/mol ��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��5��������ȼ�ϵ������ͼ��

��ͼ��������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫����֪�����ĵ缫��Ӧ��CH4 +4CO32����8e��=5CO2+2H2O�������ĵ缫��Ӧ��_______ ��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ��_________��ʵ������У���ͨ���˱�״���¿���448L�����������O2�������Ϊ20%������������ȼ�ϵ�����ı�״����CH4____________L��
��һ�̶��ݻ����ܱ������н��������·�Ӧ��
CO2(g) + H2(g)  CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
CO(g) + H2O(g)����ƽ�ⳣ���˺��¶�t�Ĺ�ϵ���£�
|
t�� |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K�ı���ʽΪ���� �� �������÷�Ӧ������ӦΪ���� ����Ӧ�������ȡ����ȡ���
(2) ���жϸ÷�Ӧ�Ƿ��Ѿ��ﵽ��ѧƽ��״̬���ǣ�
����������ѹǿ���䡡�� �£����������COŨ�Ȳ���
�ã�v(H2)��= v(H2O)�桡�� D��c(CO2) = c(CO)��
��3��ij�о�С�����÷�Ӧ��CO(g)+H2O(g)  H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
H2(g)+CO2(g) ��H=��41.2kJ/mol���Ʊ�CO2��H2�Ļ�����塣�ü�Һ����һ����CO2�ķ�������������H2��CO2������ȡ�����1L1.5mol/L��NaOH��Һ���������22.4L��������Ϊ��״���������CO2�������պ���Һ�и�����Ũ�ȴӴ�С��˳���� ��
��4���罫H2��CO2��4:1������Ȼ�ϣ����ʵ��������¿��Ƶ�CH4����֪��
CH4 (g) + 2O2(g)  CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
CO2(g)+ 2H2O��1�� ��H1����890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O��1�� ��H2����285.8 kJ/mol
H2O��1�� ��H2����285.8 kJ/mol
��CO2(g)��H2(g)��Ӧ����CH4(g)��Һ̬ˮ���Ȼ�ѧ����ʽ�� ��
��5��������ȼ�ϵ������ͼ��

��ͼ��������̼����Ϊ����ʣ���CH4Ϊȼ�ϣ�����Ϊ��������ϡ����������Ϊ�缫����֪�����ĵ缫��Ӧ��CH4 +4CO32����8e��=5CO2+2H2O�������ĵ缫��Ӧ��_______ ��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ���Ϊ�˵�ع���ʱ�����в���A���ʲμ�ѭ������A���ʵĻ�ѧʽ��_________��ʵ������У���ͨ���˱�״���¿���448L�����������O2�������Ϊ20%������������ȼ�ϵ�����ı�״����CH4____________L��
 ij�о�С�����÷�ӦCO��g��+H2O��g��?CO2��g��+2H2��g����H=-41.2kJ/mol���Ʊ�CO2��H2�Ļ�����壬����һ���о�CO2��H2�Բ�ͬ�����֮�Ȼ��ʱ�ں��������µķ�Ӧ�������ش��������⣺
ij�о�С�����÷�ӦCO��g��+H2O��g��?CO2��g��+2H2��g����H=-41.2kJ/mol���Ʊ�CO2��H2�Ļ�����壬����һ���о�CO2��H2�Բ�ͬ�����֮�Ȼ��ʱ�ں��������µķ�Ӧ�������ش��������⣺ H2(g)+CO2(g)
��H����41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
H2(g)+CO2(g)
��H����41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
 H2(g)+CO2(g) ��H=��41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
H2(g)+CO2(g) ��H=��41.2kJ/mol ���Ʊ�CO2��H2 �Ļ�����壬����һ���о�CO2��H2�Բ�ͬ������Ȼ��ʱ�ں��������µķ�Ӧ����Ӧ�á�
 CO2(g)+ 2H2O(l) ��H1����890.3 kJ/mol
CO2(g)+ 2H2O(l) ��H1����890.3 kJ/mol  H2O(l) ��H2����285.8 kJ/mol
H2O(l) ��H2����285.8 kJ/mol