题目内容
8.下列说法错误的是( )| A. | 铝与Fe2O3发生铝热反应后固体物质增重 | |
| B. | Al片溶于NaOH溶液,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 工业上电解熔融状态的Al2O3制备Al | |
| D. | 铝制容器可盛装浓H2SO4 |
分析 A、Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,由此分析解答;
B、Al片溶于NaOH溶液,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
C、电解熔融状态的Al2O3得到Al和氧气;
D、铝与冷的浓硫酸发生钝化现象.
解答 解:A、Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3═2Fe+Al2O3,铁的相对原子质量为56,而铝的相对原子质量为27,所以固体质量减轻,故A错误;
B、Al片溶于NaOH溶液,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B正确;
C、电解熔融状态的Al2O3得到Al和氧气,工业上用此方法制得铝,故C正确;
D、铝与冷的浓硫酸发生钝化现象,所以铝制容器可盛装浓H2SO4,故D正确;
故选A.
点评 本题考查铝的制备和铝的化学性质,铝与氢氧化钠反应的离子方程式中水是氧化剂,书写过程中不能漏掉水,比较容易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.有关苯分子的说法不正确的是( )
| A. | 苯分子中C原子均以sp3杂化方式成键,形成夹角为120°的三个sp3杂化轨道,故为正六边形的碳环 | |
| B. | 每个碳原子还有一个未参与杂化的2p轨道,垂直碳环平面,相互交盖,形成大π键 | |
| C. | 大π键中6个电子被6个C原子共用,故称为6中心6电子大π键 | |
| D. | 苯分子中共有十二个原子共面,六个碳碳键完全相同 |
19.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡溶液与稀硫酸的反应:OH-+H++Ba2++SO42-=BaSO4↓+H2O | |
| B. | 硫酸铝溶液中加入过量氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑ |
16.下列关于有机物的说法中,不正确的是( )
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖 |
3.有Mg、Al混合粉末10.2g,将它溶于500mL 4mol•L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2mol•L-1的氢氧化钠溶液的体积为( )
| A. | 1 000mL | B. | 500mL | C. | 100mL | D. | 1 500mL |
13.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | NH4NO3 | B. | AlCl3 | C. | Na2CO3 | D. | Al(OH)3 |
20.能将NH4Cl、AlCl3、Na2SO4三瓶溶液鉴别开的试剂是( )
| A. | NaOH 溶液 | B. | AgNO3 溶液 | C. | BaCl2 溶液 | D. | 盐酸 |
17.25℃时,将物质的量浓度相同的NaOH 溶液和CH3COOH溶液等体积相混合后,下列关系式中正确的是( )
| A. | c(H+)=c(CH3COO-)+c(OH-) | B. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | D. | c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
18.下列有关说法正确的是( )
| A. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| B. | 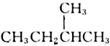 和 和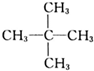 互为同分异构体 互为同分异构体 | |
| C. | 淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |