题目内容
【题目】(1)将一块未打磨过的铝片放入装有少量NaOH溶液的试管中,会发现开始没有气泡,一段时间后才产生气泡。请写出发生反应的离子方程式:___________,___________。
(2)将8gFe2O3投入到150mL某浓度的稀H2SO4中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe与Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为________。
(3)请写出制备漂白粉的离子方程式:____________。
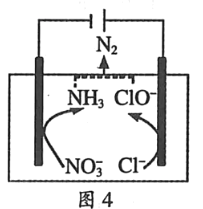
(4)配平下列离子方程式:______Fe(OH)3+ClO-+OH-=FeO42-+Cl-+H2O。
【答案】Al2O3+2OH-=2AlO2-+H2O 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2 mol/L Cl2+Ca(OH)2=Ca2++Cl-+ClO+H2O 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
【解析】
(1)开始是氧化铝与NaOH溶液反应,后来是Al与NaOH溶液反应;
(2) Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知n(NaOH)=2n(Na2SO4),由硫酸根守恒可知n(Na2SO4)=n(H2SO4),再根据c=![]() 计算;
计算;
(3)在用氯气与石灰乳反应制取漂白粉;
(4)根据电子守恒、电荷守恒、原子守恒配平方程式。
(1)反应开始时是铝片表面的Al2O3与NaOH反应产生NaAlO2、H2O,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,当Al2O3反应完全后,裸露出的Al与NaOH溶液反应产生氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Fe和Fe2O3均无剩余,而硫酸过量,加入氢氧化钠溶液使溶液中铁元素完全沉淀,最终溶液中的溶质是Na2SO4,由钠离子守恒可知:n(NaOH)=2n(Na2SO4)=0.15L×4mol/L=0.6mol,故n(Na2SO4)==0.3mol,由硫酸根守恒可知n(H2SO4)= n(Na2SO4)=0.3mol,则c(H2SO4)= 0.3mol÷0.15L=2 mol/L;
(3)在工业上用氯气与石灰乳反应制取漂白粉,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,该反应的离子方程式为:Cl2+Ca(OH)2=Ca2++Cl-+ClO+H2O;
(4)在该反应中,Fe元素化合价由反应前Fe(OH)3中的+3价变为反应后FeO42-中的+6价,化合价升高,失去3e-,Cl元素的化合价由反应前ClO-中的+1价变为反应后Cl-中的-1价,化合价降低,得到2e-,电子得失最小公倍数是6,所以Fe(OH)3、FeO42-的系数是2,ClO-、Cl-的系数是3,再根据电荷守恒,可知OH-的系数是4,最后根据原子守恒,可知H2O的系数是5,则配平后的化学方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。