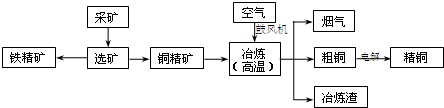
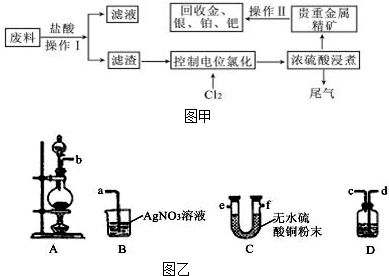
题目内容
(1)某有色金属冶炼厂排放的废气中含SO2,先用石灰浆吸收SO2,然后利用空气中的氧气将产物继续氧化成石膏(CaSO4·2H2O).写出反应的两个化学方程式:________、________.
(2)硫酸厂排放尾气中的SO2与硝酸厂排放尾气中的NO和NO2在催化剂作用下能发生氧化还原反应,释放出一种无色、无味、无毒的大气中含有的气体和一种常温(20℃)、常压(101 kPa)下的无色液体,试分别写出它们发生反应的化学方程式:________、________.
答案:
解析:
解析:
答案:(1)Ca(OH)2+SO2![]() CaSO3+H2O
CaSO3+H2O
2CaSO3+O2+4H2O![]() 2(CaSO4·2H2O)
2(CaSO4·2H2O)
(2)2SO2+2NO![]() 2SO3+N2
2SO3+N2
4SO2+2NO2![]() 4SO3+N2
4SO3+N2
解析:(1)所提供的石灰浆应该是过量的,所以不会生成Ca(HSO3)2,否则得不到CaSO4·2H2O.
(2)SO2与NOx发生反应,生成的大气中含有的气体应是N2,NOx变为N2失去了O,SO2得到O变成了SO3,SO3在常温、常压下是无色液体.

练习册系列答案
相关题目