题目内容
在一定条件下,可逆反应:N2+3H2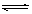 2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是
| A.加催化剂,V(正)、V(逆)都发生变化且变化的倍数相等 |
| B.加压,V(正)、V(逆)都增大,且V(正)增大的倍数大于V(逆)增大的倍数 |
| C.降温,V(正)、V(逆)都减小,且V(正)减小的倍数小于V(逆)减小的倍数 |
| D.加入氩气,V(正)、V(逆)都增大,且V(正)增大的倍数大于V(逆)增大的倍数 |
D
解析试题分析:A、正确;B、加压,平衡正向移动,V(正)增大的倍数大于V(逆)增大的倍数,正确;C、降温,平衡正向移动,且V(正)减小的倍数小于V(逆)减小的倍数,正确;D、加入不反应的气体(容器体积不变),反应速率不变,平衡不移动,错误。
考点:考查平衡移动与反应速率有关问题。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
改变下列条件,能使N2(g)+3H2(g) 2NH3(g) △H<0平衡向逆反应方向移动的是
2NH3(g) △H<0平衡向逆反应方向移动的是
| A.升高温度 | B.增大压强 | C.增大H2的浓度 | D.使用催化剂 |
T℃时,将6 mol CO2和8 mol H2充入2L密闭容器中,发生反应CO2 ( g ) + 3 H2 ( g )  CH3 OH ( g )+H2O( g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。则下列说法正确的是
CH3 OH ( g )+H2O( g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。则下列说法正确的是
| A.反应开始至a点时υ(H2) ="1" mol·L-1·min-1 |
| B.曲线II对应的条件改变是降低压强 |
| C.若曲线I对应的条件改变是升温,则该反应△H >0 |
| D.T℃时,该反应的化学平衡常数为0.125 |
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
I2在KI溶液中存在平衡: 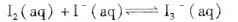 ,某I2、、KI混合溶液中, c(
,某I2、、KI混合溶液中, c(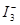 )与温度T的平衡曲线图如下。下列说法不正确的是
)与温度T的平衡曲线图如下。下列说法不正确的是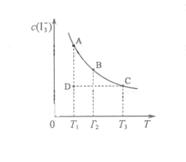
A.反应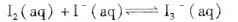 的△H>0 的△H>0 |
B.若温度为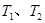 ,反应的平衡常数分别为 ,反应的平衡常数分别为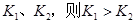 |
C.若反应进行到状态D时,一定有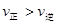 |
| D.状态A与状态B相比,状态A的c(I2) 小 |
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )
| A.a、c两点的反应速率:a>c |
| B.a、c两点气体的颜色:a深,c浅 |
| C.b、c两点的平衡常数:b<c |
| D.a、c两点气体的平均相对分子质量:a>c |
 pC(g)+qD(g) △H<0。下列结论中错误的是( )
pC(g)+qD(g) △H<0。下列结论中错误的是( ) 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)