题目内容
19.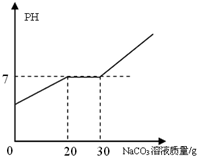 向21.88g 含有少量氯化钙的稀盐酸中加入10.6%的碳酸钠溶液,所加入的碳酸钠溶液质量和溶液PH的关系如图所示.
向21.88g 含有少量氯化钙的稀盐酸中加入10.6%的碳酸钠溶液,所加入的碳酸钠溶液质量和溶液PH的关系如图所示.(1)加入碳酸钠溶液25g时所观察到的现象是开始有气体生成,后有白色沉淀生成.
(2)原溶液中的两种溶质分别与碳酸钠完全反应生成二氧化碳0.88 g,生成碳酸钙1 g.
(3)计算加入30g碳酸钠溶液,充分反应所得溶液中溶质的质量分数.
分析 (1)开始pH值增大阶段发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,溶液PH=7不变阶段发生反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,30mL后继续滴加为氯化钠、碳酸钠混合溶液;
(2)由图可知,与盐酸反应消耗碳酸钠质量为20g×10.6%,与氯化钙反应消耗碳酸钠质量为10g×10.6%,则根据方程式中定量关系计算二氧化碳、碳酸钙质量;
(3)根据方程式计算生成氯化钠的质量,溶液总质量=21.88g+碳酸钠溶液质量-二氧化碳质量-碳酸钙质量,进而计算溶液中NaCl质量分数.
解答 解:(1)开始pH值增大阶段发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,溶液PH=7不变阶段发生反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,30mL后继续滴加为氯化钠、碳酸钠混合溶液,则加入碳酸钠溶液25g时所观察到的现象是:开始有气体生成,后有白色沉淀生成,
故答案为:开始有气体生成,后有白色沉淀生成;
(2)由图可知,与盐酸反应消耗碳酸钠溶液为20g,则碳酸钠质量为20g×10.6%,设生成二氧化碳质量为m,则:
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
20g×10.6% m
所以m=$\frac{20g×10.6%×44}{106}$=0.88g,
由图可知,与氯化钙反应消耗碳酸钠溶液为30g-20g=10g,则碳酸钠质量为10g×10.6%,设生成碳酸钙质量为x,则:
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
10g×10.6% x
所以x=$\frac{10g×10.6%×100}{106}$=1g,
故答案为:0.88;1;
(3)由方程式可知,盐酸反应生成氯化钠为$\frac{20g×10.6%×117}{106}$=2.34g,由氯化钙反应生成氯化钠为$\frac{10g×10.6%×117}{106}$=1.17g,故生成NaCl总质量为2.34g+1.17g=3.51g,
溶液总质量=21.88g+30g-0.88g-1g=50g,
故溶液中NaCl质量分数为$\frac{3.51g}{50g}$×100%=7.02%,
答:所得溶液中溶质的质量分数为7.02%.
点评 本题考查化学方程式计算、溶液质量分数计算,难度不大,侧重对基础知识巩固.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | C2H6 | B. | C4H10 | C. | C5H12 | D. | C7H16 |

(1)该合成路线对于环境保护的价值在于减少烟道气中二氧化碳排放到空气中造成温室效应.
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因:HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-;.
(3)CH3OH(l)、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9KJ/mol.
(4)据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇也已成为现实.
2CO2(g)+6H2(g),CH3CH2OH(g)+3H2O(g);下列叙述正确的是acd.
a.使用催化剂可能大大提高生产效率
b.反应需在300℃进行可推测该反应是吸热反应
c.充入过量CO2气体可提高H2的转化率
d.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
(5)在一定体积的密闭容器中,CO2和H2也可以进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
其化学平衡常数K和温度T的关系如表所示:
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为吸热反应(填“吸热”或“放热”).
②能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变 B.混合气体中c(CO)不变 C.v(H2)正=v(H2O)逆
D.c(CO)=c(H2) E.混合气体的密度保持不变 F.混合气体的平均相对分子质量保持不变
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L,c(H2)为 1.5mol/L,c(CO) 为 1mol/L,c(H2O) 为 3mol/L,则下一时刻,反应向逆向移动(填“正向”“逆向”或“不”).
| A. | +6 | B. | +5 | C. | +4 | D. | +3 |
| A. | MnO2 | B. | MnCl2 | C. | K2MnO4 | D. | KMnO4 |
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒 | 饱和Na2CO3溶液、0.5mol/L FeCl3溶液 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、 0.100 0 mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2C03 | B. | HCl | C. | Na2S04 | D. | KN03 |
