题目内容
15.如表实验能达到预期目的是( )| 选项 | 实验 | 实验目的或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
| B | 将某气体通入品红溶液,溶液褪色 | 检验气体中的SO2 |
| C | 测定等物质的量浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
| D | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4溶液和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.能和CO2反应生成白色胶状沉淀,当CO2过量时沉淀不溶解的离子有AlO2-、SiO32-;
B.能使品红溶液褪色的气体有SO2、Cl2等;
C.酸的酸性越强,其相同浓度的钠盐溶液的pH越小;
D.酸性高锰酸钾溶液具有强氧化性,能氧化双氧水生成氧气.
解答 解:A.和CO2反应生成白色胶状沉淀,当CO2过量时沉淀不溶解的离子有AlO2-、SiO32-,所以根据实验现象不能判断溶液中是否含有AlO2-,故A错误;
B.能使品红溶液褪色的无色气体不一定是二氧化硫,如氯气、臭氧等,故B错误;
C.酸的电离平衡常数越大,其酸根离子水解程度越小,则其相应的钾盐pH越小,所以测定等物质的量浓度的HCOOK和K2S溶液的pH比较Ka(HCOOH)和Ka2(H2S)的大小,故C正确;
D.酸性高锰酸钾溶液具有强氧化性,能氧化双氧水生成氧气,所以不能比较CuSO4和KMnO4的催化效果,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及探究影响反应速率因素、酸性强弱判断、元素化合物性质、离子检验等知识点,明确实验原理、元素化合物性质是解本题关键,注意C中HS-对应的酸根离子是S 2-,为易错点.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
6.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 锂在氧气中燃烧,1 mol O2作氧化剂时得到的电子数为2NA | |
| D. | 常温常压下,17克NH3中含有共价键的数目为3NA |
3.下列关于物质性质的叙述中正确的是( )
| A. | Cl2能与金属活动性顺序表中大多数金属反应 | |
| B. | N2是大气中的主要成分之一,雷雨时可直接转化为NO2 | |
| C. | 硫是一种黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| D. | 浓硫酸可以干燥Cl2,但不能干燥SO2 |
10.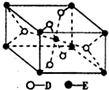 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4和BD气体的热化学方程式:
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
20.下列物质属于分子晶体的是( )
| A. | 熔点是1070℃,易溶于水,水溶液能导电 | |
| B. | 熔点是10.31℃,液态不导电,水溶液能导电 | |
| C. | 能溶于水,熔点812.8℃,沸点是1446℃ | |
| D. | 熔点是97.80℃,质软、导电,密度是0.97g/cm3 |
4.下列无色透明溶液,能大量共存的是( )
| A. | K+、Na+、HCO3-、OH- | B. | Cl-、MnO4-、K+、Na+ | ||
| C. | SO42-、K+、Cl-、NO3- | D. | H+、NO3-、AlO2-、CO32- |
5.下列叙述不正确的是( )
| A. | 为防止氯化亚铁溶液变质,在氯化亚铁溶液中加铁粉 | |
| B. | 二氧化硫和二氧化氮都能形成酸雨,酸雨的pH小于5.6 | |
| C. | 用铁片区分浓硫酸和稀硫酸 | |
| D. | 用干燥的红色石蕊试纸检验氨气 |
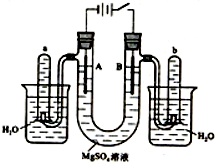 如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题:
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色.(指示剂的pH变色范围:6.8~8.0,酸色-红色,碱色-黄色)回答下列问题: ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤ ⑥
⑥ ⑦
⑦ ⑧
⑧ ⑨
⑨ ⑩
⑩
 表示的有机物的分子式C6H14;
表示的有机物的分子式C6H14; 中含有的官能团的名称为酚羟基、酯基.
中含有的官能团的名称为酚羟基、酯基.