题目内容
【题目】把一定质量的镁、铝混合物投入到1 mol/L的盐酸中,待金属完全溶解后,向溶液中加入1mol/L的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
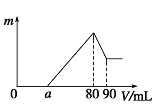
(1)金属铝的质量为_________;
(2)图像中80-90mL之间发生的离子方程式:____。
【答案】 0.27g Al(OH)3+OH-=AlO2-+2H2O
【解析】(1)根据图可知,加入氢氧化钠溶液后首先发生的反应是中和过量的酸:H++OH-=H2O,总共消耗了amL氢氧化钠溶液;a-80段是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,80-90段是Al(OH)3的溶解:,从横坐标80mL到90mL这段可计算出氢氧化铝的物质的量是1mol/L×(0.09L-0.08L)=0.01mol,则根据铝原子守恒可知n(Al)=0.01mol,质量是0.01mol×27g/mol=0.27g;(2)根据以上分析可知图像中80-90ml之间发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下: 
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
3,5﹣二甲氧基苯酚 | / | 33﹣36 | / | 易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取.
(1)①分离出甲醇的操作是 .
②萃取用到的分液漏斗使用前需并洗净,分液时有机层在分液漏斗的填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3 溶液洗涤的目的是;用饱和食盐水洗涤的目的是 .
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥.
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.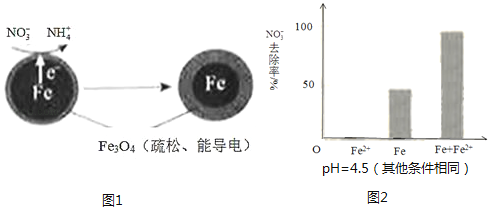
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
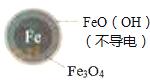
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .