题目内容
15.NaCl是一种化工原料,可以制备一系列物质,如图所示.下列说法正确的是( )
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2在任何条件下都不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |
分析 A、根据碳酸钠与碳酸氢钠的物理性质判断;
B、结合反应方程式化合价的变化判断;
C、铁能在氯气中燃烧生成棕黄色的烟FeCl3;
D、根据元素的化合价是否变化判断.
解答 解:A、碳酸钠易溶于水,碳酸氢钠能溶于水,但是NaHCO3在水中的溶解度比Na2CO3的小,故A错误;
B、2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O,Cl元素的化合价既升高又降低,所以Cl2既是氧化剂,又是还原剂,故B正确;
C、在加热或点燃的条件下,Fe能与氯气发生化合反应,3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故C错误;
D、氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故D错误;
故选B.
点评 本题考查了盐的溶解性、氧化还原反应、氧化剂还原剂等问题,是小型综合题;氧化还原反应、氧化剂还原剂根据化合价的变化判断即可,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.关于钠的叙述不正确的是( )
| A. | 钠质软,其新切的表面容易失去光泽 | |
| B. | 钠是电和热的良导体 | |
| C. | 钠保存在煤油中,是因为钠的密度比煤油小 | |
| D. | 钠在空气中燃烧发出黄色火焰 |
10.对某些离子的检验及结论一定正确的是( )
| A. | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- | |
| B. | 通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- | |
| C. | 加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ | |
| D. | 加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |
20.下列叙述中与物质化学性质无关的是( )
| A. | 用铂丝蘸取Na2CO3溶液在酒精灯焰上灼烧,观察到黄色火焰 | |
| B. | 明矾可用作净水剂 | |
| C. | 木条蘸取浓硫酸后变黑色 | |
| D. | 用水(滴加了酚酞试液)和氨气做喷泉实验 |

 燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.
燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液. .
.
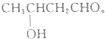
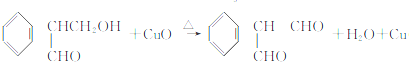

 、
、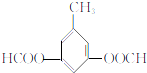 (不考虑立体异构)•
(不考虑立体异构)•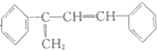 的合成路线.
的合成路线.