题目内容
如图所示的装置: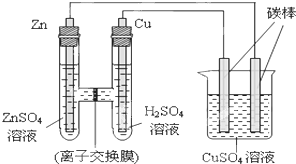
该装置中离子交换膜只允许

该装置中离子交换膜只允许
阴离子(或SO42-)
阴离子(或SO42-)
离子通过.反应一段时间后,向烧杯中加入0.1mol Cu(OH)2后恰好恢复到反应前的CuSO4溶液的浓度和pH.则反应过程中消耗锌的质量为13
13
g,烧杯左侧碳棒上析出物质的量为0.1
0.1
mol.在此过程中烧杯中右侧电极上发生的电极反应方程式为:Cu2++2e-=Cu和2H++2e-=H2↑
Cu2++2e-=Cu和2H++2e-=H2↑
.分析:由图可知,该装置左端为原电池,电解硫酸铜溶液,Zn为负极,离子交换膜只允许阴离子通过;烧杯中发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4,若通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,则电解硫酸铜之后发生水的电解,以此来解答.
| ||
解答:解:该装置左端为原电池,Zn为负极,Cu为正极,正极上氢离子放电,则为使溶液不显电性,硫酸根离子通过离子交换膜移动到负极;
烧杯中溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,
发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O
2H2↑+O2↑,
即烧杯中右侧电极上发生的电极反应为Cu2++2e-=Cu和2H++2e-=H2↑,由Cu(OH)2
CuO+H2O,
则转移的电子为(0.1mol×2+0.1mol×2)=0.4mol,
则原电池中Zn-2e-=Zn2+,则消耗的Zn为
×65g/mol=13g,
电解池中左侧碳棒上4OH--4e-=2H2O+O2↑,则析出氧气的物质的量为
=0.1mol,
故答案为:阴离子(或SO42-);13;0.1;Cu2++2e-=Cu和2H++2e-=H2↑.
烧杯中溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,
发生2CuSO4+2H2O
| ||
| ||
即烧杯中右侧电极上发生的电极反应为Cu2++2e-=Cu和2H++2e-=H2↑,由Cu(OH)2
| ||
则转移的电子为(0.1mol×2+0.1mol×2)=0.4mol,
则原电池中Zn-2e-=Zn2+,则消耗的Zn为
| 0.4mol |
| 2 |
电解池中左侧碳棒上4OH--4e-=2H2O+O2↑,则析出氧气的物质的量为
| 0.4mol |
| 4 |
故答案为:阴离子(或SO42-);13;0.1;Cu2++2e-=Cu和2H++2e-=H2↑.
点评:本题考查原电池及电解池,明确加入0.1mol Cu(OH)2后恰好恢复原样来确定反应中转移的电子时解答的关键,并熟悉发生的电极反应来解答,题目难度中等.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
某同学用如图所示的装置来制取和探究气体(H2、O2、Cl2、SO2、NO2)的性质.
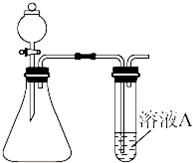 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作
(2)如果用该装置制取H2、O2,可选用的试剂组合是 (填序号).
(3)五种气体中,可同时采用如图所示两种收集装置收集的气体是 .
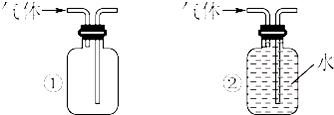
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式: .
②若溶液A为溴水,通入SO2后现象是 ;若溶液A为溴化钠溶液,通入氯气时反应的离子方程式为 .实验证明Br2、SO2和Cl2氧化性由大到小的顺序为 .
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为 .两同学还想比较Cl2和
SO2漂白的差异性,还需要的操作和可能观察到的现象为 .
 (1)装药品前,应先进行的操作
(1)装药品前,应先进行的操作(2)如果用该装置制取H2、O2,可选用的试剂组合是
| H2 | O2 | |
| ① | Zn、稀盐酸 | KClO3、MnO2 |
| ② | Zn、稀硫酸 | H2O2溶液、MnO2 |
| ③ | Zn、稀硝酸 | KMnO4 |
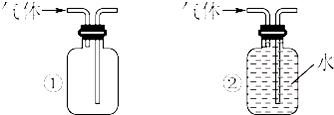
(4)两同学分别利用该装置制取并探究气体性质.同学甲利用亚硫酸钠固体与硫酸反应制取SO2,同学乙用高锰酸钾和盐酸制取氯气.请回答:
①写出亚硫酸钠固体与硫酸反应制取SO2的化学方程式:
②若溶液A为溴水,通入SO2后现象是
③两同学想比较Cl2和SO2漂白速率的快慢,A溶液选取的是相同量的品红溶液.同时制取气体Cl2和SO2,观察品红溶液褪色的时间,比较褪色的快慢,该方法存在的缺陷为
SO2漂白的差异性,还需要的操作和可能观察到的现象为
 已知外电路中,电子由铜流向a极.有关如图所示的装置分析合理的一项是( )
已知外电路中,电子由铜流向a极.有关如图所示的装置分析合理的一项是( )