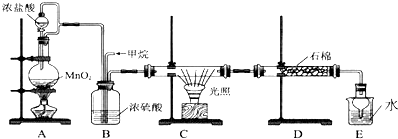
题目内容
11.加“碘”食盐较多使用的碘酸钾(KIO3),在工业上可用电解法制取.以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI+3H2O$\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑.下列有关说法不正确的是( )| A. | 电解时,石墨作阴极,不锈钢作阳极 | |
| B. | 电解时,阳极反应是:I--6e-+3H2O═IO3-+6H+ | |
| C. | 溶液调节至强酸性,对生产不利 | |
| D. | 电解后阴极周围溶液的pH升高 |
分析 由方程式额控制,KI被氧化生成KIO3,则石墨应为阳极,发生I--6e-+3H2O═IO3-+6H+,阴极生成氢气,结合电极方程式解答该题.
解答 解:A.根据电池反应式知,阳极上碘离子放电生成碘酸根离子,则阳极应该为惰性电极石墨,阴极为铁,故A错误;
B.电解时,阴极上氢离子放电生成氢气,阳极上碘离子放电生成KIO3,电极反应为:I--6e-+3H2O=IO3-+6H+,故B正确;
C.KI和KIO3在酸性溶液中放出氧化还原反应,不利于生产碘酸钾,故C正确;
D.阴极发生2H++2e-=H2↑,氢离子浓度减小,pH增大,故D正确.
故选A.
点评 本题考查了电解原理,为高频考点,侧重学生的分析能力的考查,注意从化合价的角度判断电极反应,根据电池反应式判断阴阳极材料、电极反应,并结合盐的性质分析解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示.
其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图 .
.
(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
则:该反应的△H<0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
| X | ||||
| Y | Z | W |
(1)写出X的原子结构示意图
 .
.(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
19.下列有关糖类、油脂和蛋白质的叙述正确的是( )
| A. | 油脂的水解反应又叫做皂化反应 | |
| B. | 一定条件下,糖类都能发生水解反应 | |
| C. | 蛋白质发生变性后,直接生成氨基酸 | |
| D. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 |
6.如图1和图2是A、B两种物质的核磁共振氢谱.请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( )
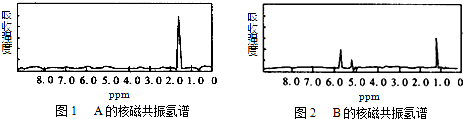

| A. | A是C3H6、B是C2H6 | B. | A是C6H6、B是C4H6 | C. | A是C6H6、B是C2H6 | D. | A是C3H8、B是C6H6 |
3.将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体(NOx)的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
20.中国古代四大发明之一的黑火药,它的爆炸反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑,当发生上述反应时,2molKNO3可氧化木炭的物质的量是( )
| A. | 3mol | B. | 2.5mol | C. | 1mol | D. | 0.5mol |
18.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.如表是元素周期表的一部分.
请回答下列问题.
(1)非金属性最强的元素名称为氟,它位于元素周期表中的位置是第二周期ⅦA族.
(2)硅元素的原子结构示意图是 ,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.
,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.
(3)硼酸(H3BO3)的酸性<(填“>”或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C,故非金属性B<C,最高氧化物对应的水化物酸性H3BO3<H2CO3.
(4)NH3的电子式为 ,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.
,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
(1)非金属性最强的元素名称为氟,它位于元素周期表中的位置是第二周期ⅦA族.
(2)硅元素的原子结构示意图是
 ,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.
,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.(3)硼酸(H3BO3)的酸性<(填“>”或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:B和C 位于同一周期,原子序数B<C,原子半径B>C,得电子能力B<C,故非金属性B<C,最高氧化物对应的水化物酸性H3BO3<H2CO3.
(4)NH3的电子式为
 ,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.
,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O.