题目内容
取1.43g Na2CO3?10H2O溶于水配成100mL溶液,求:
(1)Na2CO3溶液的物质的量浓度
(2)Na+物质的量浓度
(3)取出20ml该溶液用水稀释,使Na2CO3溶液的物质的量浓度变为0.004mol/L,求加入水的体积(设稀释时,对溶液体积的影响忽略不计)
解:(1)n(Na2CO3?10H2O)= =0.005mol,
=0.005mol,
c(Na2CO3)= =0.05mol/L,
=0.05mol/L,
答:Na2CO3溶液的物质的量浓度为0.05mol/L.
(2)c(Na+)=2c(Na2CO3)=2×0.05mol/L=0.1mol/L,
答:Na+物质的量浓度为0.1mol/L.
(3)20ml该溶液,n(Na2CO3)=0.02L×0.05mol/L=0.001mol,
设加入水的体积为VL,
则 ,解之得V=0.23,即230ml,
,解之得V=0.23,即230ml,
答:加入水的体积为230mL.
分析:根据n= =c×V计算相关量,根据溶液稀释前后溶质的物质的量不变计算加入水的体积.
=c×V计算相关量,根据溶液稀释前后溶质的物质的量不变计算加入水的体积.
点评:本题考查物质的量浓度的计算题目,难度不大,注意有关计算公式的运用.
 =0.005mol,
=0.005mol,c(Na2CO3)=
 =0.05mol/L,
=0.05mol/L,答:Na2CO3溶液的物质的量浓度为0.05mol/L.
(2)c(Na+)=2c(Na2CO3)=2×0.05mol/L=0.1mol/L,
答:Na+物质的量浓度为0.1mol/L.
(3)20ml该溶液,n(Na2CO3)=0.02L×0.05mol/L=0.001mol,
设加入水的体积为VL,
则
 ,解之得V=0.23,即230ml,
,解之得V=0.23,即230ml,答:加入水的体积为230mL.
分析:根据n=
 =c×V计算相关量,根据溶液稀释前后溶质的物质的量不变计算加入水的体积.
=c×V计算相关量,根据溶液稀释前后溶质的物质的量不变计算加入水的体积.点评:本题考查物质的量浓度的计算题目,难度不大,注意有关计算公式的运用.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目


 利用如图装置处理气体,保持瓶口向上,以下方法正确的是
利用如图装置处理气体,保持瓶口向上,以下方法正确的是 mol/L
mol/L mol/L
mol/L mol/L
mol/L mol/L
mol/L 海带灰
海带灰 水溶液
水溶液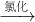
 →碘单质.下列叙述正确的是
→碘单质.下列叙述正确的是