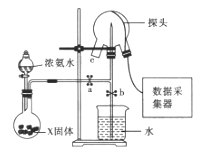
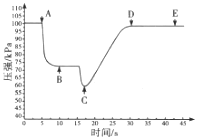
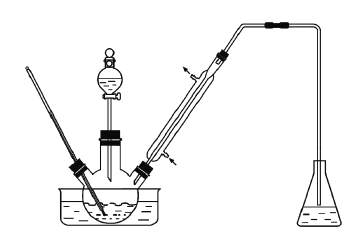
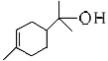
题目内容
【题目】高温下,某可逆反应达到平衡,其平衡常数为K= ![]() ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
A.该反应的化学方程式为CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的焓变为正值
【答案】D
【解析】
A、该反应的方程式为CO2(g)+H2(g) ![]() CO(g)+H2O(g),选项A错误;
CO(g)+H2O(g),选项A错误;
B、升高温度,H2的浓度减小,平衡向正反应方向进行,K值增大,选项B错误;
C、升高温度,正、逆反应速率均增大,选项C错误;
D、高温下,某可逆反应达到平衡,其平衡常数为K=![]() ,则该反应的方程式为CO2(g)+H2(g)
,则该反应的方程式为CO2(g)+H2(g) ![]() CO(g)+H2O(g),恒容时,升高温度,H2的浓度减小,说明平衡向正反应方向进行,因此正反应是吸热反应,即该反应的焓变为正值,选项D正确;
CO(g)+H2O(g),恒容时,升高温度,H2的浓度减小,说明平衡向正反应方向进行,因此正反应是吸热反应,即该反应的焓变为正值,选项D正确;
答案选D。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
【题目】如表陈述Ⅰ、Ⅱ均正确,且两者在反应原理上相似的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 将 |
|
B |
|
|
C | 玻璃试剂瓶可用于盛放氢氟酸 | 石英坩埚不能用于熔化NaOH |
D |
|
|
A.AB.BC.CD.D