题目内容
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
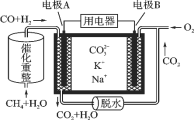
A.反应CH4+H2O![]() 3H2+CO,每消耗1mol CH4转移12 mol电子
3H2+CO,每消耗1mol CH4转移12 mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
【答案】D
【解析】
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-。
A. 反应CH4+H2O![]() 3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
B. 电极A上H2参与的电极反应为:H2+CO32--2e-=H2O+CO2,故B错误;
C. 电池工作时,CO32-向负极移动,即向电极A移动,故C错误;
D.燃料电池通入的氧气在正极上发生还原反应,B为正极,电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-,故D正确;
故选D。

【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是____________(填0~1、1~2、2~3、3~4、4~5)min,原因是____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为____________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列____________以减慢反应速率。(填写代号)
A.冰块B.HNO3溶液C.CuSO4溶液
(3)C同学为了探究Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。可通过观察___________________________现象,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________,