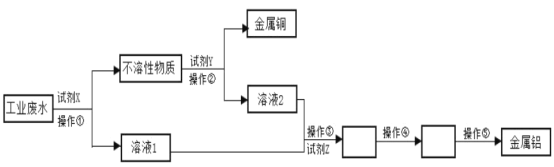
��Ŀ����
����Ŀ�������仯�������ճ�������������;�㷺������FeSO4�Ʊ���ԭ���۵Ĺ�ҵ�������£�
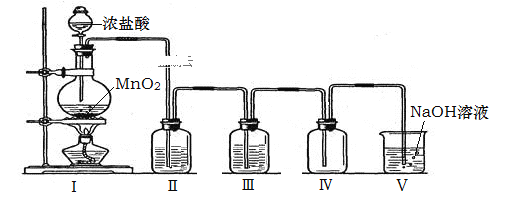
ʵ�����п���FeSO4�������ۺ�ϡ���ᷴӦ�Ƶã���NH4HCO3������װ��ģ�����������е���ת�������ڡ�
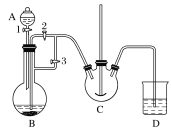
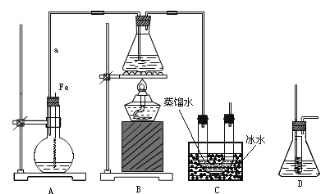
��1��װ��A��������________��װ��B��ʢ�ŵ�ҩƷ��________��NH4HCO3ʢ����װ��________�С�
��2��ʵ������У��������ɵ�FeSO4��Һ��NH4HCO3��Һ��ϣ�����������______________��
������Ҫ��Ӧ�����ӷ���ʽΪ_________��FeSO4��ҺҪ���������Ƶ�ԭ����_______��������õ�FeSO4�Ƿ���ʵķ�����_________________��
��3��������̵���ҪĿ������ȥ����ˮ���ù����л�������FeCO3�ڿ����б�����ΪFeOOH���÷�Ӧ�Ļ�ѧ����ʽΪ________��ȡ������FeCO3��Ʒ12.49 g����̿��Ϻ��գ����յõ���ԭ����6.16 g��������Ʒ������FeOOH��������________ g��
���𰸡���Һ©�� ���� C ����D�������������رջ���3������2 Fe2����2 HCO3 =FeCO3����CO2����H2O����Fe2����HCO3 =FeCO3����H����HCO3��H��=CO2����H2O�� ���������ױ����� ȡ��Ʒ�����Һ��ȡ������Һ���Թ��У������Թ��м���KSCN��Һ���۲��Ƿ���Ѫ��ɫ 4FeCO3��O2��2H2O=4FeOOH��4CO2 0.89
��������
����װ��ͼ����֪�رջ���2������3��B��������ϡ���ᷴӦ�����������������������ɵ�������C�п����ų����ٹرջ���3������2����������������������ѹ��C����̼����立�Ӧ��
�������Ϸ�������1��װ��A�Ƿ�Һ©����ʢ��ϡ���ᣬװ��B��ʢ�����ۣ�ϡ���������۷�Ӧ����H2��FeSO4��װ��C��ʢ��NH4HCO3��
��2������D�������Ѵ���ʱ������װ���п������ž����رջ���3������2�������������½�FeSO4��Һѹ��C�з�����Ӧ��̼����狀��������� ��C�з�Ӧ����̼��������ͬʱ�ų�������̼����Ӧ�����ӷ���ʽ��Fe2����2HCO3 =FeCO3����CO2����H2O ��FeSO4���л�ԭ�ԣ��ױ�O2��������FeSO4��ҺҪ�������䡣��FeSO4���ʣ�����Һ����Fe3�����ɣ�Fe3����KSCN��Һ�Ժ�ɫ��������KSCN��Һ������õ�FeSO4�Ƿ���ʡ�
��3��FeCO3��H2O��O2��Ӧ����FeOOH��CO2����Ӧ����ʽ��4FeCO3��O2��2H2O=4FeOOH��4CO2���������FeCO3��Ʒ��FeCO3��FeOOH�����ʵ����ֱ�Ϊxmol��ymol����xmol��116 g��mol��1��ymol��89 g��mol��1��12.49g��56 g��mol��1����x��y����6.16 g����ã�x��0.1 mol��y��0.01 mol����m��FeOOH����0.89 g��

 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�����Ŀ������ˮ���ᣨ��˾ƥ�֣���Ŀǰ����ҩ��֮һ��ʵ����ͨ��ˮ��������������Ʊ���˾ƥ�ֵ�һ�ַ������£�
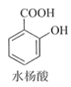 +��CH3CO��2O����������
+��CH3CO��2O����������![]()
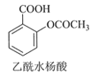 +CH3COOH
+CH3COOH
ˮ���� | ������ | ����ˮ���� | |
�۵�/�� | 157��159 | 72�� 74 | 135��138 |
����ܶ�/��g �� cm3�� | 1.44 | 1.10 | 1.35 |
��Է������� | 138 | 102 | 180 |
ʵ����̣���100 mL��ƿ�м���ˮ����6.9 g��������10 mL�����ҡ��ʹ������ȫ�ܽ⡣�����μ�0.5 mLŨ�������ȣ�ά��ƿ���¶���70 �����ң� ��ַ�Ӧ�������������²�����
���ڲ��Ͻ����½���Ӧ��Ļ���ﵹ��100 mL��ˮ�У��������壬���ˡ�
�����ýᾧ��Ʒ����50 mL����̼��������Һ���ܽ⡢���ˡ�
����Һ��Ũ�����ữ����ȴ�����˵ù��塣
�ܹ��徭�����ð�ɫ������ˮ���ᾧ��5.4 g���ش��������⣺
��1���úϳɷ�Ӧ��Ӧ����_____���ȡ������ţ�
A ��ˮԡ B �ƾ��� C ú���� D ��¯
��2�����в��������У�������ʹ�õ���_____�����ţ���
��3��������ʹ����ˮ��Ŀ����_____��
��4�����б���̼�����Ƶ�������_____���Ա���˳�ȥ�������ʡ�
��5���ܲ��õĴ�������Ϊ_____��
��6����ʵ��IJ�����_____%��
����Ŀ��ij�о���ѧϰС���ͬѧ�������ͼװ����ȡ�屽�������飺
��֪���Ҵ��ڼ��ȵ������¿���HBr��Ӧ�õ������飨CH3CH2Br��������ijЩ������������ ����ʾ��
�ܽ��ԣ������������ܼ��� | �е㣨�棩 | �ܶȣ�g/mL�� | |
�Ҵ� | ��ˮ���ܣ��������л��ܼ� | 78.5 | 0.8 |
������ | ������ˮ���������л��ܼ� | 38.4 | 1.4 |
��ش��������⣺
��1��B�з�����Ӧ����Ŀ�����Ļ�ѧ����ʽΪ______��
��2������a��������______��
��3����Ӧ��Ϻ�U�ι��ڵ�������______������������ʱ����IJ���������______��
��4������ʵ�����ô���˿�������۵��ŵ㣺______��
��5��ʵ����ɺ�ijͬѧ���������м���NaOH�Ҵ���Һ�����ȣ�Ϊ�ж��䷢������ˮ�� ��Ӧ������ȥ��Ӧ����ͬѧ����˼ס�������������
�����ף���Ӧ���Һ�е�����ˮ������Һ��ɫ�ܿ���ȥ�����֤����������ȥ��Ӧ
�����ң���Ӧ���Һ�е�������KMnO4��Һ������Һ��ɫ��dz����֤����������ȥ��Ӧ��
���й�����ʵ�鷽����������_____��
A ��������ȷ B ��������ȷ C ��������������ȷ