题目内容
1. A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:
A、B、C、D四种短周期元素,且A、B、D为相邻的同周期元素,C、B同主族,B、C可形成共价化合物BC3和BC2,A的原子结构示意图图,据此填空:(1)A的元素名称为硅,其气态氢化物的化学式为SiH4.
(2)A、B、C、D四种元素的原子,半径由小到大的顺序为O<S<P<Si
(3)B和D最高价氧化物的水化物化学式分别为H2SO4和H3PO4.
分析 A、B、C、D四种短周期元素,由A的电子排布可知x=2,则A的电子排布2、8、4,故A为硅(Si)元素;C、B同主族,B、C可形成共价化合物BC3和BC2,可知B为S元素,C为O元素;A、B、D为相邻的同周期元素,则D为P元素,据此进行解答.
解答 解:A、B、C、D四种短周期元素,由A的电子排布可知,x=2,故A的电子排布2、8、4,故A为硅(Si)元素;C、B同主族,B、C可形成共价化合物BC3和BC2,可知B为S元素,C为O元素;A、B、D为相邻的同周期元素,故D为P元素,
(1)由上述分析可知,A为硅元素,其气态氢化物的化学式为 SiH4,
故答案为:硅; SiH4;
(2)同周期自左而右原子半径逐渐减小,则原子半径Si>P>S,同主族自上而下原子半径增大,故原子半径S>O,所以原子半径半径由小到大的顺序为:O<S<P<Si,
故答案为:O<S<P<Si;
(3)B为S元素,最高价为+5价,则其最高价氧化物对应水合物的化学式为:H2SO4;D为P元素,最高正化合价为+5,最高价氧化物的水化物化学式为H3PO4,
故答案为:H2SO4;H3PO4.
点评 本题考查位置结构性质的相互关系,题目难度中等,推断元素为解答关键,明确原子核外电子排布规律为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
7.人民币一硬币有明亮的银白色的光泽且密度较大,小明同学认为一元硬币中含有铁,他这一想法属于科学探究过程的( )
| A. | 提出问题 | B. | 获得结论 | C. | 猜想 | D. | 反思 |
8.在温度t1和t2下(t2>t1),卤素单质X2(g)和H2反应生成HX的平衡常数如下表:
仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,得到的结论是( )
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| 化学方程式 | F2+H2?2HF | H2+Cl2?2HCl | H2+Br2(g)?2HBr | H2+I2(g)?2HI(g) |
| 平衡常数K(t1) | 1.8×1036 | 9.7×1012 | 5.6×107 | 43 |
| 平衡常数K(t2) | 1.9×1032 | 4.2×1011 | 9.3×106 | 34 |
a.HX的生成反应是放热反应
b.在相同条件下,平衡时X2的转化率逐渐降低
c.X2与H2反应的剧烈程度逐渐减弱
d.HX的还原性逐渐减弱
e.HX的稳定性逐渐减弱.
| A. | 只有ab | B. | 只有abe | C. | 只有abce | D. | abcde |
6.下列说法中,正确的是( )
| A. | 反应是放热反应还是吸热反应,由生成物与反应物的焓值差决定 | |
| B. | 升高温度,可以改变化学反应的反应热 | |
| C. | △H的大小与热化学方程式中的化学计量数无关 | |
| D. | 1 mol H2在足量Cl2中完全燃烧所放出的热量,是H2的燃烧热 |
13.下列有关说法正确的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 一个化学反应的△H与实际参加化学反应的物质的多少无关,而与热化学方程式的计量系数有关 | |
| C. | 中和热测定实验中,将碱溶液分多次缓慢加入酸溶液中可减小实验误差 | |
| D. | 在海轮外壳连接锌块保护外壳不受腐蚀采用的是牺牲阳极的阴极保护法,属于电解原理 |
10.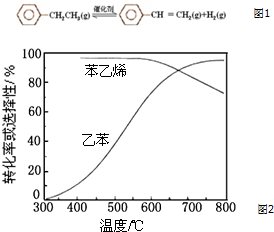 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:
(1)已知:
反应的△H=+124kJ•mol-1,X=412kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{α{\;}^{2}}{(1-α{\;}^{2})}p$(用α等符号表示),在平衡体系中充入氖气反应速率将减小(填“增大”“减小”“不变”).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图1:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(5)产物中另一种物质常用做燃料电池的材料,若电解质为熔融碳酸盐,其负极电极反应式为H2-2e-+CO32-=H2O+CO2↑.
 乙苯催化脱氢制苯乙烯反应如图1:
乙苯催化脱氢制苯乙烯反应如图1:(1)已知:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | X | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{α{\;}^{2}}{(1-α{\;}^{2})}p$(用α等符号表示),在平衡体系中充入氖气反应速率将减小(填“增大”“减小”“不变”).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图1:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用
(5)产物中另一种物质常用做燃料电池的材料,若电解质为熔融碳酸盐,其负极电极反应式为H2-2e-+CO32-=H2O+CO2↑.
11.标况下,2.2gCH4和C2H4组成的混合气体所占的体积为2.24L,则该混合气中CH4和C2H4的比值是( )
| A. | 摩尔比1:1 | B. | 摩尔比1:2 | C. | 质量比1:1 | D. | 质量比7:4 |