题目内容
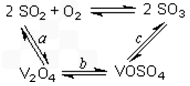
(1) 钒触媒(V2O5)是二氧化硫氧化的催化剂,在催化氧化的过程中产生了一连串的中间体(如图)。其中步骤c的化学方程式可表示为:____________________-。
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
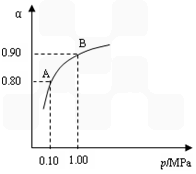
A与B表示不同压强下的SO2转化率,试分析通常情况下工业生产中采用常压的原因是______________________。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。则反应2SO3 2SO2+O2 在550 ℃时的平衡常数是____________。
2SO2+O2 在550 ℃时的平衡常数是____________。
 2SO2+O2 在550 ℃时的平衡常数是____________。
2SO2+O2 在550 ℃时的平衡常数是____________。 (1)4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
(2)使用常压SO2就可以达到较高的转化率;2.5×10-3 mol/L
 2V2O5+4SO3
2V2O5+4SO3 (2)使用常压SO2就可以达到较高的转化率;2.5×10-3 mol/L

练习册系列答案
相关题目
(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)=10.00 mL,V(采集烟气)=100.0 mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-98.3 kJ·mol-1。
2SO3(g) ΔH =-98.3 kJ·mol-1。
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 2 mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3) /mol·L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ 。







 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。