题目内容
已知Fe+2Fe3+=3Fe2+,Fe3+遇SCN-溶液变红,Fe2+遇SCN-不变红.现取铁粉和氧化铁的混合物样品14.88g,加入125mL稀H2SO4,使之充分反应.当固体粉末完全溶解时,收集到0.15mol气体;当向溶液中滴加KSCN溶液时,溶液不显红色,再用氢氧化钠溶液中和过量的硫酸,并继续加碱溶液至0.75mol,恰好把溶液中的金属阳离子全部沉淀出来.试求:
(1)原样品中氧化铁的质量分数;
(2)上述稀H2SO4中溶质的物质的量.
答案:
解析:
提示:
解析:
|
【解答】(1)32.26%;(2)0.375mol 【巧解导析】(1)设混合物中Fe2O3的物质的量为x,根据电子守恒有:n(Fe)=n(Fe2O3)+n(H2), 所以ω(Fe2O3)= (2)设H2SO4的物质的量为y,由反应方程式(略)可看出,反应后全部的 n(H2SO4)=n( |
提示:
|
本题关键是从错综复杂的关系中提炼出反应过程中的本质及不变量,利用电子守恒、元素守恒及电荷守恒建立关系式.由于本题涉及反应多,关系错综复杂,若用常规解法列方程,不仅繁琐费时,而且极易出错. |

练习册系列答案
相关题目
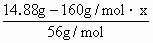 =x+0.15,解得x=0.03mol,
=x+0.15,解得x=0.03mol,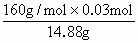 ×100%=32.26%.
×100%=32.26%.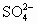 都转入Na2SO4中,故由元素及电荷守恒有如下关系:
都转入Na2SO4中,故由元素及电荷守恒有如下关系: n(Na+),即y=
n(Na+),即y= (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.