题目内容
短周期元素X、Y、Z、W在元素周期表中的位置如下表,且Z族元素的化合物种类最多.则下列说法正确的是( )
| X | Y | ||
| Z | W |
| A、Z单质的熔点是四种单质中最低的 |
| B、Y的最高价氧化物的水化物酸性最强 |
| C、碳元素可与W形成直线型分子 |
| D、ZY4是由极性键形成的极性分子 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Z族元素的化合物种类最多,则Z为ⅣA族元素,根据X、Y、Z、W在短周期及元素周期表中的位置可知,X、Y处于第二周期、Z、W处于第三周期,所以Z为Si元素,W为S元素、X为N元素、Y为F元素,据此对各选项进行判断.
解答:
解:Z族元素的化合物种类最多,则Z为ⅣA族元素,根据X、Y、Z、W在短周期及元素周期表中的位置可知,X、Y处于第二周期、Z、W处于第三周期,所以Z为Si元素,W为S元素、X为N元素、Y为F元素,
A.Z为Si元素,晶体硅属于原子晶体,而其它元素形成的单质都属于分子晶体,所以Z的单质的熔沸点最高,故A错误;
B.Y为F元素,F元素的非金属性最强,不存在氧化物,也不存在最高价含氧酸,故B错误;
C.W为S元素,C与S形成的化合物为二硫化碳,二氧化硫与二氧化碳结构相似,为直线型结构,故C正确;
D.Z为Si元素、Y为F元素,ZY4是四氯化碳,四氯化碳为极性键形成的非极性分子,故D错误;
故选C.
A.Z为Si元素,晶体硅属于原子晶体,而其它元素形成的单质都属于分子晶体,所以Z的单质的熔沸点最高,故A错误;
B.Y为F元素,F元素的非金属性最强,不存在氧化物,也不存在最高价含氧酸,故B错误;
C.W为S元素,C与S形成的化合物为二硫化碳,二氧化硫与二氧化碳结构相似,为直线型结构,故C正确;
D.Z为Si元素、Y为F元素,ZY4是四氯化碳,四氯化碳为极性键形成的非极性分子,故D错误;
故选C.
点评:本题考查了位置结构与性质的关系,题目难度中等,根据书写知识正确推断各元素名称为解答关键,注意掌握常见原子结构与元素周期表、元素周期律的关系,试题有利于培养学生的分析、理解能力.

练习册系列答案
相关题目
下列化学用语描述中正确的是( )
A、含18个中子的氯原子的核素符号:
| ||
B、比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | ||
| C、HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、次氯酸的结构式:H×Cl-O |
下列说法不正确的是( )
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、用甘氨酸和丙氨酸缩合最多可形成4种二肽 |
| C、分子式为C4H6O2,既能与NaOH溶液反应又能与溴的四氯化碳溶液反应的有机物有4种 |
D、乳酸薄荷醇酯(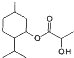 )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
下列各离子组可在同一无色溶液中大量共存的是( )
| A、Na+、Mg2+.、OH-、Cl- |
| B、Cu2+、Ba2+、NO3-、SO42- |
| C、Na+、Mg2+、CO32-、SO42- |
| D、H+、K+、Cl-、NO3- |
 某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下:
某化学研究小组欲探究从茶叶提取咖啡因并测定其含量,设计了探究实验步骤如下: