题目内容
两个烧杯中各放入相同体积的3 mol·L-1H2SO4,置于天平的两个托盘上;调节天平,使达到平衡;向一个烧杯中加入10.8 g铝,向另一个烧杯中加入10.8 g镁.问反应完毕后,天平可能发生怎样变化?试根据计算说明.
解析:
| 解析:2Al + 3H2SO4====Al2(SO4)3+3H2↑
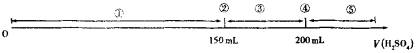
2×27 g 3 mol 6 g 10.8 g 3×V1 m1(H2)=1.2 g V1=0.2L Mg + H2SO4====MgSO4+H2↑ 24 1 mol 2g 10.8 g 3×V2 m2(H2)=0.9 g V2=0.15 L 如果以消耗的H2SO4计算产生的H2: H2SO4 ~ H2 H2SO4 ~ H2 1mol 2 g 1 mol 2 g 3×0.2 mol m1(H2)=1.2 g 3×0.15 mol m2(H2)=0.9 g 显然要用反应消耗H2SO4溶液(3 mol·L-1)的体积数值V(mL)来划界,如下图所示:
讨论:①当3 mol·L-1H2SO4的V<150 mL时,Al、Mg均过量H2SO4为不足量,所产生的H2的质量完全由消耗H2SO4的体积而定,此时消耗等量的H2SO4放出等量的H2.天平在反应后仍平衡. ②当3 mol·L-1H2SO4的V=150 mL时,Al过量,3×0.15 mol H2SO4参加反应产生0.9 g H2,此时Mg正好与酸反应完全生成0.9 g H2,天平仍平衡. ③当3 mol·L-1H2SO4处于:150<V<200,Al过量,消耗酸的体积大于150 mL小于200 mL,产生H2在0.9~1.2 g之间,Mg为不足量,它最多只产生H2 0.9 g,此时加Al的烧杯的H2放出大于0.9 g,这边的托盘轻些,向上. ④当3 mol·L-1的H2SO4的V=200 mL时,Al正好反应完,产生H21.2 g,而Mg仅产生0.9 g H2,显然天平状态同③. ⑤当3 mol·L-1H2SO4 V>200 mL时,H2SO4过量,Mg、Al均为不足量,但Al生H2 1.2 g,Mg生H2 0.9 g,仍同③. 上述①②合并,③④⑤合并.结论只两个: (i)V(H (ii)V(H2SO4)>150 mL,天平倾斜,加铝的这边的托盘向上. 归纳:处理类似天平平衡问题设计的化学计算要掌握讨论法和使用解题技巧,用讨论法解这类题目,既能避免漏解,又能锻炼养成思维的缜密性和整体性.
|