题目内容
9.日常生活用的火柴头上含有KClO3、MnO2、S等化学物质,某兴趣小组为检验其中某些成分,设计了如图1实验流程图: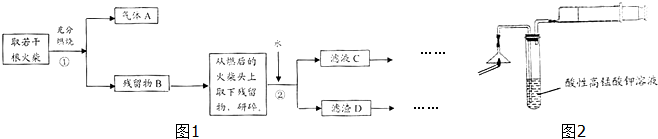
请回答以下问题:
(1)写出步骤①中发生反应的化学方程式2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑、S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
(2)为验证气体A,按图2所示进行实验:将两根火柴放在如图2所示实验装置中漏斗下面,用一根燃着的火柴点燃它,慢慢拉动注射器活塞抽气,让火柴燃烧产生的气体通过酸性高锰酸钾溶液,①若能观察到酸性高锰酸钾溶液溶液(紫红色)褪色的现象,即可证明火柴头上含有S元素.
②可用于替代试管中酸性高锰酸钾溶液的试剂有AC (填标号)
A.品红溶液 B.饱和石灰水 C.稀溴水 D.烧碱溶液
(3)要证明火柴头中含有Cl元素的后续实验步骤是取滤液C,加入AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素.
(4)有学生提出检验火柴头上KClO3的另一套实验方案,主要实验步骤如下:
ⅰ刮取没有燃烧的火柴头,小心研碎,称得质量为2.45g;
ⅱ用适量蒸馏水充分浸泡后过滤、洗涤残渣;
ⅲ往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液,
有白色沉淀生成,充分反应后,过滤、洗涤沉淀;
ⅳ干燥沉淀物,称得其质量为1.435g.
①实验中发生的有关的离子反应方程式为ClO3-+3NO2-=Cl-+3NO3-和Cl-+Ag+=AgCl↓.
②实验测得火柴头中KClO3的质量分数为50%.
分析 (1)依据火柴头上含有KClO3、MnO2、S物质的性质分析判断,氯酸钾在二氧化锰做催化剂作用分解生成氯化钾和氧气,硫单质燃烧和氧气反应生成二氧化硫气体;
(2)①利用燃烧可能生成二氧化硫气体,结合二氧化硫具有还原性,可以还原高锰酸钾溶液使溶液褪色证明;
②能够与二氧化硫出现明显反应现象的试剂即可,如溴水、品红溶液等;
(3)氯离子和酸性硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;
(4)①涉及的反应有:氯酸根离子与亚硝酸根离子反应生成氯离子和硝酸根离子,氯离子与银离子反应生成氯化银白色沉淀,据此写出反应的离子方程式;
②根据n=$\frac{m}{M}$计算出氯化银的物质的量,然后依据氯元素守恒计算测得的火柴头中KClO3的质量分数.
解答 解:(1)反应①中的反应为:氯酸钾在二氧化锰做催化剂作用分解生成氯化钾和氧气,硫单质燃烧和氧气反应生成二氧化硫气体,反应的化学方程式分别为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑、S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,
故答案为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
(2)①火柴头上含有KClO3、MnO2、S,硫反应生成二氧化硫,通入高锰酸钾溶液中会反应氧化还原反应,高锰酸钾溶液褪色;故KMnO4溶液(紫红色)褪色,
故答案为:酸性高锰酸钾溶液溶液(紫红色)褪色;
②书写高锰酸钾溶液用于检验二氧化硫,也可以用品红溶液或溴水代替酸性高锰酸钾,所以AC正确,
故答案为:AC;
(3)氯离子能够还与硝酸酸化的硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,所以检验方法为:取滤液C,加入HNO3和AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素,
故答案为:取滤液C,加入AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素(回答加入酸化的AgNO3溶液或用HNO3酸化的AgNO3溶液均可);
(4)①实验过程中涉及的离子反应为:ClO3-+3NO2-=Cl-+3NO3-、Cl-+Ag+=AgCl↓,
故答案为:ClO3-+3NO2-=Cl-+3NO3-和Cl-+Ag+=AgCl↓;
②依据氯元素守恒计算,沉淀物为AgCl,称得其质量为1.435g,则氯化银的物质的量为:$\frac{1.435g}{143.5g/mol}$=0.01mol,根据氯元素守恒可知KClO3物质的量为0.01mol,
则该火柴头中KClO3的质量分数为:$\frac{0.01mol×122.5g/mol}{2.45g}$×100%=50%,
故答案为:50%.
点评 本题考查了探究物质组成、测量物质含量的方法及性质实验方案的设计,题目难度中等,明确发生反应的现象及常见物质性质是解题关键,试题充分考查学生的分析、理解能力及化学实验能力.

| A. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | 工业上通常用电解钠、镁、铝对应的氯化物制得该三种金属单质 | |
| C. | Si、P、S、Cl相应的氢化物的还原性依次增强 | |
| D. | 测定相同条件下NaHCO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
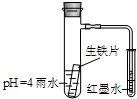 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生氧化反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 导管内液面回升时,碳极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
| A. | 碱式氯化铝 | B. | 明矾 | C. | 绿矾 | D. | 胆矾 |
| A. | 大多数有机物难溶于水,易溶于汽油、酒精、苯等有机溶剂;大多有机反应较慢,常伴有副反应发生,需催化 | |
| B. | 乙烯和苯分子中都有碳碳双键,分子中所有原子都共平面;溴苯、硝基苯、四氯化碳,它们的密度都比水大 | |
| C. | 乙烯和苯互为同系物 | |
| D. | 苯和四氯化碳都能使溴水褪色,都不能使酸性高锰酸钾溶液褪色;一定条件下,苯能与液溴或浓硝酸发生取代反应,也能与H2发生加成反应 |
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 4:1 |
| A. | 铁能被磁铁吸引,且纯铁比生铁更易生锈 | |
| B. | 向煤中加入适量石灰石,可大大减少燃烧产物中SO2的量 | |
| C. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 维生素C能帮助人体将食物中摄取的Fe3+转化为Fe2+,因为维生素具有还原性 |
| A. | 化学是一门以实验为基础的自然科学 | |
| B. | 化学为解决环境、能源和资源等问题提供更多的有效途径 | |
| C. | 化学不支持高新技术的快速发展 | |
| D. | 学好化学的关键是掌握实验方法以及完成化学实验所必需的技能 |
| A. | 相同体积,不同密度的N2和CO两种气体 | |
| B. | 相同密度的O2和O3两种气体 | |
| C. | 相同质量,不同密度的C2H4和C3H8两种气体 | |
| D. | 相同物质的量,不同体积的NH3和CH4两种气体 |