题目内容
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。(1)A的最高价氧化物的水化物是__________(填化学式)。
(2)物质E中所包含的化学键有__________,写出C、D两元素形成的化合物C2D的电子式____________________。
(3)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为____________________。
(1)HNO3 (2)离子键、(非极性)共价键 ![]() (3)25%
(3)25%
解析:A的原子序数最小,A原子的最外层上有5个电子,说明是N;E是淡黄色的固体Na2O2,则B是O,C是Na,D的L层电子数等于K、M两个电子层上的电子数之和是S;AB和AB2分别是NO和NO2;设NO体积为x mL,NO2体积为y mL,可列方程式:x+y=48,x+![]() y=24,解得x=12.
y=24,解得x=12.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

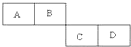 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.