题目内容
【题目】氢氧化亚铁的制备:在一支试管中加入少量的硫酸亚铁溶液,然后滴入氢氧化钠溶液。
(1)观察到的实验现象是_________。
(2)用化学方程式表示产生上述现象的原因:_______________、________________
(3)在制取氢氧化亚铁时,可将吸有氢氧化钠溶液的长胶头滴管伸入到硫酸亚铁液面下,再挤出氢氧化钠溶液的目的是_________。
(4)下列各图所示的实验中能较长时间看到Fe(OH) 2 白色沉淀的是_______。
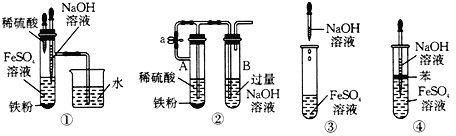
【答案】试管中先有白色沉淀生成,然后迅速变为灰绿色,最终变为红褐色 FeSO4+2NaOH=Na2SO4+Fe(OH)2↓ 4Fe(OH)2+O2+2 H2O=4Fe(OH)3 防止氢氧化钠滴入时带入的空气将生成的氢氧化亚铁氧化成氢氧化铁 ①②④
【解析】
(1)硫酸亚铁与氢氧化钠反应生成氢氧化亚铁白色沉淀和硫酸钠,氢氧化亚铁被空气中的氧气反应生成氢氧化铁;
(2)上述反应的方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2 H2O=4Fe(OH)3;
(3)生成的氢氧化亚铁在溶液中生成,可减少与空气中氧气的接触,较长时间的观察氢氧化亚铁;
(4)装置①中Fe与稀硫酸生成的氢气能把试管中的空气排净;
装置②中开始时,Fe与稀硫酸生成的氢气能把试管中的空气排净,当有Fe剩余时,夹住止水夹a,可使试管A中的硫酸亚铁溶液进入试管B;
装置③中无法阻止空气中的氧气氧化生成的氢氧化亚铁;
装置④中,苯起到液封的作用,可阻止溶液与空气接触。
(1)硫酸亚铁与氢氧化钠反应生成氢氧化亚铁白色沉淀和硫酸钠,氢氧化亚铁被空气中的氧气反应生成氢氧化铁,观察到的现象为试管中先有白色沉淀生成,然后迅速变为灰绿色,最终变为红褐色;
(2)上述反应的方程式为FeSO4+2NaOH=Na2SO4+Fe(OH)2↓,4Fe(OH)2+O2+2 H2O=4Fe(OH)3;
(3)生成的氢氧化亚铁在溶液中生成,可减少与空气中氧气的接触,较长时间的观察氢氧化亚铁,则目的为防止氢氧化钠滴入时带入的空气将生成的氢氧化亚铁氧化成氢氧化铁;
(4)装置①中Fe与稀硫酸生成的氢气能把试管中的空气排净,防止氧气氧化氢氧化亚铁,符合题意,①正确;
装置②中开始时,Fe与稀硫酸生成的氢气能把试管中的空气排净,当有Fe剩余时,夹住止水夹a,可使试管A中的硫酸亚铁溶液进入试管B,可有效防止氧气氧化氢氧化亚铁,符合题意,②正确;
装置③中无法阻止空气中的氧气氧化生成的氢氧化亚铁,与题意不符,③错误;
装置④中,苯起到液封的作用,可阻止溶液与空气接触,效防止氧气氧化氢氧化亚铁,符合题意,④正确;
答案为①②④。