题目内容
反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1,在800℃时的化学平衡常数K=1.0.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是( )
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
| A、v(正)>v(逆) |
| B、v(正)<v(逆) |
| C、v(正)=v(逆) |
| D、无法判断 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:根据浓度熵Q与平衡常数K的大小来判断v(正)和v(逆)的大小,如果浓度熵Q=K,说明达化学平衡状态,如果Q>K,v(正)<v(逆);如果Q<K,v(正)<v(逆).
解答:
解:反应CO(g)+H2O(g)?CO2(g)+H2(g)在某时刻的浓度幂之积为Q=
=
=0.94<1.0,反应正向进行,v(正)>v(逆),故选:A.
| C(H2)×C(CO2) |
| C(CO)×C(H2O) |
| 2×2 |
| 0.5×8.5 |
点评:本题主要考查通过浓度商来判断化学平衡移动的方向,来判断正逆反应的关系,难度中等.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、Ca(HCO3)2溶液中滴入过量 NaOH 溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、向NaAlO2 溶液中通人过量的 C02:CO2+2H20+A102-═Al(OH)3↓+HCO3- |
| C、0.01mol/L NH4Al(SO4)2 溶液与 O.02mol/L Ba(OH)2溶液等体积混合:Al3++2S042-+2Ba2++40H-═2BaSO4↓+AlO2-+2H20 |
| D、向Ca(ClO)2溶液中通入过量的 SO2:C10-+SO2+H2O═HClO+HSO3- |
可逆反应 2X+Y?2Z(g)△H<0,气体的平均摩尔质量(M)随温度的降低而增大.则下列说法正确的是( )
| A、X和Y可能都是固体 |
| B、X和Y一定都是气体 |
| C、若Y为固体,X一定是气体 |
| D、X和Y不可能都是气体 |
要检验市售的金制首饰是否用纯金制成,方法之一是将饰品浸入某溶液中,过一段时间取出后称量,根据质量是否变化即作出判断,该溶液是( )
| A、盐酸 | B、硫酸 | C、硝酸 | D、王水 |
有两种气态烃的混合物,将该混合物2.24L(标准状况)完全燃烧,产物先后通过盛浓硫酸洗气瓶和碱石灰的干燥管(假设吸收完全),洗气瓶和干燥管的质量分别增加4.5g和13.2g.则该混合气体的组成和比例可能是( )
| A、CH4和C4H6 1:1 |
| B、CH4和C4H10 5:1 |
| C、C3H4和C3H8 3:1 |
| D、C2H2和C4H8 任意比 |
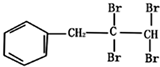 与NaOH的水溶液共热的化学方程式为
与NaOH的水溶液共热的化学方程式为
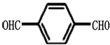 )的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为
)的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为
