题目内容
7.工业生产硝酸铵的流程图如下:请回答下列问题:(1)写出硝酸铵在工农业生产中的重要作用可做氮肥等(任写一条).
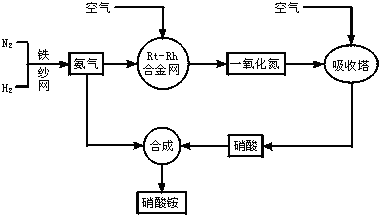
(2)已知N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量<(填“<”“>”“=”)92.4kJ,理由是在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ.
(3)写出氨催化氧化的化学方程式:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{△}$4NO+6H2O.
分析 (1)硝酸铵含有氮元素,氮元素是植物生长需要的一种元素;
(2)依据热化学方程式的意义及可逆反应特点解答;
(3)氨气催化氧化生成一氧化氮和水.
解答 解:( 1)硝酸铵含有氮元素,氮元素是植物生长需要的一种元素,是一种很好的氮肥,
故答案为:可做氮肥等;
(2)N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1表示在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,但是该反应为可逆反应,在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,不可能进行完全,所以放出的热量小于92.4kJ;
故答案为:<;在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ;
(3)氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{△}$4NO+6H2O.
点评 本题考查了热化学方程式的意义,明确工业合成氨为可逆反应,熟悉可逆反应不能进行到底的特点是解题关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
18.下列各组物质中,所含分子数相同的是( )
| A. | 5g H2和5g N2 | B. | 224mlN2(标准状况)和0.1molCO | ||
| C. | 16gO2和0.5molSO2 | D. | 22.4LH2O(标准状况)和1molO2 |
12.下列饮食习惯科学的是( )
| A. | 人类需要的蛋白质可由鸡蛋提供,多吃有益 | |
| B. | 为防止变胖,炒菜时不放油 | |
| C. | 合理摄入糖类、油脂等,注意膳食平衡 | |
| D. | 淀粉、油脂、蛋白质为人体提供热能,只要这三种摄入量足够就可以 |
16.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯
②氧化性最强的是锂原子
③在自然界中均以化合态形式存在
④它们的氧化物都只有M2O、M2O2两种形式
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥密度按Li-Cs顺序呈依次递增趋势
⑦离子半径:Rb+>K+>Na+、Cs>Cs+>K+
⑧都可以保存在煤油中.
①金属性最强的是铯
②氧化性最强的是锂原子
③在自然界中均以化合态形式存在
④它们的氧化物都只有M2O、M2O2两种形式
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥密度按Li-Cs顺序呈依次递增趋势
⑦离子半径:Rb+>K+>Na+、Cs>Cs+>K+
⑧都可以保存在煤油中.
| A. | ①③⑤⑦ | B. | ①④⑤⑥⑦ | C. | ①②⑥⑧ | D. | ①③④⑤ |
17.实验室用下列两种方法制取氯气:①用87g MnO2与足量的浓盐酸反应②用含HCl 146g的浓盐酸与足量的MnO2反应;则在同温同压下所得氯气的体积( )
| A. | ①比②多 | B. | ②比①多 | C. | 一样多 | D. | 无法比较 |
 如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请回答:
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.请回答: