题目内容
3.国务院办公厅2014年5月印发了《2014~2015年节能减排低碳发展行动方案》.下列做法违背低碳发展原则的是( )| A. | 发展氢能和太阳能 | B. | 限制塑料制品的使用 | ||
| C. | 提高原子利用率,发展绿色化学 | D. | 尽量用纯液态有机物代替水作溶剂 |
分析 根据低碳经济的理念进行分析,低碳就是减少二氧化碳的排放.
A.氢能燃烧生成水以及太阳能都无污染且属于可再生能源;
B.塑料是含碳的有机高聚物,限制塑料制品的使用可减少白色污染;
C.发展绿色化学,可把反应物转化为环保、健康、安全的产品;
D.纯液态有机物与减少二氧化碳的排放无关.
解答 解:A.开发利用氢能和太阳能等新能源,无污染且属于可再生能源,可以减少二氧化碳的排放,造成环境污染等,故A正确;
B.限制塑料制品的使用,可以减少白色污染,符合低碳经济的理念,故B正确;
C.绿色化学是指无污染、无公害、尽可能地把反应物转化为环保、健康、安全的产品,提高原子利用率,发展绿色化学符合低碳经济的理念,故C正确;
D.用纯液态有机物代替水作溶剂,与减少二氧化碳的排放无关,故D错误;
故选D.
点评 本题主要考查了与节能减排相关的知识,依据低碳就是减少二氧化碳的排放进行解答,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
13.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 焰火的五彩缤纷是某些金属元素化学性质的展现 | |
| B. | 将煤气化后再作为能源,可减少PM2.5引起的危害 | |
| C. | 用激光笔分到照射盛有蓝墨水、FeCl3 溶液的玻璃杯均出现光亮的通路 | |
| D. | 氨气液化时能吸收大量的热,常用来做冷冻剂 |
14.铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2$\stackrel{高温}{→}$2PbO+2SO2;
③制粗铅:PbO+C$\stackrel{高温}{→}$Pb+CO↑;PbO+CO$\stackrel{高温}{→}$Pb+CO2.下列说法正确的是( )
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2$\stackrel{高温}{→}$2PbO+2SO2;
③制粗铅:PbO+C$\stackrel{高温}{→}$Pb+CO↑;PbO+CO$\stackrel{高温}{→}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 | |
| D. | 将1 mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
11.下列对有关物质性质的分析正确的是( )
| A. | Na久置于空气中,最终生成NaHCO3 | |
| B. | 在高温下用氢气还原AlCl3可制取金属铝 | |
| C. | SiO2与焦炭反应,再经化学提纯得高纯硅 | |
| D. | N2在放电条件下与O2反应生成NO2 |
18.a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示.
请回答:
(l)d属于d区的元素,其基态原子的价电子排布图为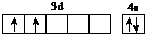 .
.
(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种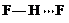 、
、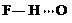 、
、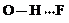 、
、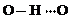 任意一种.
任意一种.
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
| a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第4纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(l)d属于d区的元素,其基态原子的价电子排布图为
 .
.(2)b与其同周期相邻元素第一电离能由大到小的顺序为N>O>C(用元素符号表示).
(3)c的氢化物水溶液中存在的氢键有4种,任意画出一种
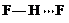 、
、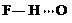 、
、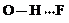 、
、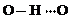 任意一种.
任意一种.(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为SiO2>CO2(用化学式表示).若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为平面三角形;A的中心原子的轨道杂化类型为sp3杂化;与A互为等电子体的一种分子为SO3(填化学式).
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的 晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为H4Cu3Au,若该晶体的相对分子质量为M,密度为ag/cm3,则晶胞的体积为$\frac{M}{a{N}_{A}}$ cm3(NA用表示阿
伏加德罗常数的值).
8.X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具有相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A. | X与Y形成的化合物只有一种 | |
| B. | R的氢化物的热稳定性比W的强 | |
| C. | 原子半径:r(Z)<r(R) | |
| D. | Y的最高价氧化物的水化物的酸性比W的强 |
15.电视连续剧《大宋提刑官》中的主人公宋慈在案件侦破中常使用“银针验毒”,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列有关说法正确的是( )
| A. | X的化学式为AgS | |
| B. | 银针验毒时,空气中氧气发生氧化反应 | |
| C. | 反应中Ag和H2S均是还原剂 | |
| D. | 每生成1mo1X会转移2mo1电子 |
12.三氯化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气发生氧化还原反应,产物有HF、NO和HNO3,下列说法中,错误的是( )
| A. | 在潮湿天气,NF3泄漏常常容易察觉 | |
| B. | 一旦NF3泄露,可以用石灰水溶液喷淋的方法减少污染 | |
| C. | 上述反应中,被还原与被氧化的元素的物质的量之比为2:1 | |
| D. | 若生成22.4L(标准状况)NO气体,反应转移的电子数目为2mol |
13.下列根据实验操作和实验现象所得出的结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向2mL 2%CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后滴加M溶液,加热 | 未出现砖红色沉淀 | M中不含醛基 |
| B | 在CuSO4溶液中介入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| C | 向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液 | 出现褐色沉淀 | N不是卤代烃 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2已氧化变质 |