��Ŀ����
2��A��Jʮ�����ʾ��ɶ�����Ԫ����ɣ��ת����ϵ��ͼ1��ʾ����Ӧ���������ֲ����ԣ�������ÿ�����ǻ����������ʾ����ٺ���ͬһ�ֵ������ڵ�Ԫ�أ�����֪��A���ɵؿ��к�����ߵ�Ԫ����ɵĵ��ʣ�DΪ���ӻ�������������Ӿ����н���Ԫ�أ�EΪ�γ��������Ҫ�ɷ֣�HΪ����ɫ���廯���J���ȼҵ����Ҫԭ�ϣ�
�밴Ҫ��ش��������⣺
��1���Ʊ�������C�ķ����ж��֣�����������ʵ���Ҳ����ķ�Ӧ���ӷ���ʽΪAl3++3NH3•H2O=Al��OH��3��+3NH4+��������D��Һ�ʼ��ԣ������ӷ���ʽ��ʾ��ԭ��AlO2-+2H2O?Al��OH��3+OH-��
��2��E������Ԫ�طֱ��Ӧ��̬�⻯����ȶ�����ǿ����Ϊ���ѧʽ��H2O��H2S�����ǵķе����ϴ��ԭ����H2O���Ӽ���������ã��ʷе�ϸߣ���H2S���Ӽ�û�������Ϊ�˷�ֹE�Ի�������Ⱦ����ҵ����������E�ij����Լ�Ϊʯ��ˮ��ˮ��E��g�� ת��ΪF��g��ʱ�¶Ȳ���̫�߸������ڸ÷�Ӧ�Է����е�ԭ���ǡ�H��0������S��0���������G��Ũ��Һ���������·�Ӧ����E�Ļ�ѧ����ʽ��2Fe+6H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Fe2��SO4��3+3SO2��+6H2O��
��3����H���ں������ʱ����A�����Ϊ1.12L��������Ϊ��״���£�ʱ��ת�Ƶĵ�����Ϊ6.02��1022��
����ⱥ��J��Һ���ò���X2ͨ��һ��Ũ�ȵ�����������Һ�У�����ǡ����ȫ��Ӧʱ����֪��Ӧ���̷��ȣ����������������ֺ�XԪ�ص����ӣ������������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���ı仯ʾ��ͼ��ͼ2��ʾ��д���÷�Ӧ�����ӷ���ʽ��6Cl2+12OH-=8Cl-+3ClO-+ClO3-+6H2O��
���� �������ʾ��ɶ�����Ԫ����ɣ���ÿ��С�������ڵ��������ʾ����ٺ��е��������е�һ����ͬԪ�أ�A�ǵؿ��к�����ߵ�Ԫ����ɵĵ��ʣ���A��O2��EΪ�γ��������Ҫ�ɷ֣���E��SO2��FΪSO3��G��H2SO4��HΪ����ɫ���廯����Һ��е�������Ԫ�أ���HΪNa2O2��J���ȼҵ����Ҫԭ�ϣ���������ת���õ�I��Iת���õ�J���������ƿ���ֱ��ת���õ�J����J��NaCl��IΪNaOH��DΪ���ӻ�������������Ӿ����н���Ԫ�أ��Һ��е�������Ԫ�أ�����D��NaAlO2�����ת����ϵ����֪B��Al2O3��C��Al��OH��3���ݴ˽��
��� �⣺�������ʾ��ɶ�����Ԫ����ɣ���ÿ��С�������ڵ��������ʾ����ٺ��е��������е�һ����ͬԪ�أ�A�ǵؿ��к�����ߵ�Ԫ����ɵĵ��ʣ���A��O2��EΪ�γ��������Ҫ�ɷ֣���E��SO2��FΪSO3��G��H2SO4��HΪ����ɫ���廯����Һ��е�������Ԫ�أ���HΪNa2O2��J���ȼҵ����Ҫԭ�ϣ���������ת���õ�I��Iת���õ�J���������ƿ���ֱ��ת���õ�J����J��NaCl��IΪNaOH��DΪ���ӻ�������������Ӿ����н���Ԫ�أ��Һ��е�������Ԫ�أ�����D��NaAlO2�����ת����ϵ����֪B��Al2O3��C��Al��OH��3��
��1��Al��OH��3������ǿ�ᡢǿ�ʵ�������ʺ��������백ˮ��Ӧ�Ʊ�����Ӧ���ӷ���ʽΪ��Al3++3NH3•H2O=Al��OH��3��+3NH4+��
D��NaAlO2��ƫ��������ǿ�������Σ�ƫ�����������ˮ���ʹ����Һ�ʼ��ԣ�ˮ�����ӷ���ʽΪ��AlO2-+2H2O?Al��OH��3+OH-��
�ʴ�Ϊ��Al3++3NH3•H2O=Al��OH��3��+3NH4+��AlO2-+2H2O?Al��OH��3+OH-��
��2��E��SO2������Ԫ�ض�Ӧ�⻯��ΪH2O��H2S�����ڷǽ�����O��S�����⻯���ȶ���H2O��H2S��H2O���Ӽ���������ã��е�ϸߣ���H2S���Ӽ�û��������е�ϵͣ�
Ϊ�˷�ֹSO2�Ի�������Ⱦ����ҵ����������SO2�ij����Լ�Ϊʯ��ˮ��ˮ��
���ڷ�Ӧ�ġ�H��0����S��0��SO2��g�� ת��ΪSO3��g��ʱ�¶Ȳ���̫�߸������ڸ÷�Ӧ�Է����У�
�������H2SO4��Ũ��Һ���������·�Ӧ����SO2�Ļ�ѧ����ʽ��2Fe+6H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Fe2��SO4��3+3SO2��+6H2O��
�ʴ�Ϊ��H2O��H2S��H2O���Ӽ���������ã��ʷе�ϸߣ���H2S���Ӽ�û�������ʯ��ˮ��ˮ����S��0��2Fe+6H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$Fe2��SO4��3+3SO2��+6H2O��
��3���������ʵ���Ϊ$\frac{1.12L}{22.4L/mol}$=0.05mol��ת�Ƶ�����ĿΪ0.05mol��2��[0-��-1��]��6.02��1023mol-1=6.02��1022��
����ⱥ��NaCl��Һ����Cl2 ͨ��һ��Ũ�ȵ�����������Һ�У�����ǡ����ȫ��Ӧʱ����֪��Ӧ���̷��ȣ����������������ֺ�ClԪ�ص����ӣ�����ͼ��֪��ClO-�����ʵ���Ϊ0.06mol��ClO3-�����ʵ�����0.02mol������ת�Ƶ����غ��n��Cl-��=0.06mol����1-0��+0.02mol����5-0��=0.16mol��
������ԭ���غ�����������ʵ���=$\frac{��0.16+0.06+0.02��mol}{2}$=0.12mol��
��������KCl��KClO��KClO3�Ļ�ѧ������֮��=0.12��0.16��0.06��0.02=6��8��3��1��
����ԭ���غ�ø÷�Ӧ����ʽΪ��6Cl2+12KOH�T8KCl+3KClO+KClO3+6H2O�����ӷ���ʽΪ��6Cl2+12OH-=8Cl-+3ClO-+ClO3-+6H2O��
�ʴ�Ϊ��6.02��1022��6Cl2+12OH-=8Cl-+3ClO-+ClO3-+6H2O��
���� ���⿼�����ʵ��ƶϣ��������ʵ������������ƶ����ʣ��Ƕ�ѧ���ۺ������Ŀ��飬��Ҫѧ����������Ԫ�ػ�����֪ʶ���ѶȽϴ�3�����ӷ���ʽ����д��ʵ�ʿ���������ԭ��Ӧ���㣬ȷ���������ӻ�ѧ�������ǹؼ���

| A�� | c��OH-��=c��Na+��+c��H+�� | |
| B�� | ����Һ�е�c��OH-��=1.0��10-3mol•L-1 | |
| C�� | ��ˮϡ��104��������Һ�Լ��� | |
| D�� | ��pH=3��HF��Һ��������������Һ��c��Na+��=c��F-��+c��HF�� |
 �׳ơ�һ���㡱���ж����ʱ���ʳ�ú�����˸��࣬�����°�����һ���㡱�ķ��ӽṹ��ͼ��ʾ������˵����ȷ���ǣ�������
�׳ơ�һ���㡱���ж����ʱ���ʳ�ú�����˸��࣬�����°�����һ���㡱�ķ��ӽṹ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | lmol���л����������2molH2�����ӳɷ�Ӧ | |
| B�� | ���л����ܷ���ȡ�����ӳɺ�������Ӧ | |
| C�� | ���л���ķ���ʽΪC7H6O3 | |
| D�� | ���л����һ�ַ�����ͬ���칹���ܷ���������Ӧ |
 ���屽��ӫ���źţ����������Ϊ��̱�ʽ�Ĺ��ף����屽һ��ȡ������ĿΪ��������
���屽��ӫ���źţ����������Ϊ��̱�ʽ�Ĺ��ף����屽һ��ȡ������ĿΪ��������| A�� | 4 | B�� | 6 | C�� | 7 | D�� | 11 |
| A�� | NH4+��Al3+��NO3-��AlO2- | B�� | Na+��Fe3+��HSO3-��OH- | ||
| C�� | Cu2+��NH4+��SO42-��Cl- | D�� | K+��H+��I-��ClO- |
| A�� | ���������pH������ʹ�����������NaOH��Һ��Ӧ������NaOH�����ʵ�����ͬ | |
| B�� | �����£�ij���ʵ�ˮ��Һ��pH��7���������һ�������ǿ�������� | |
| C�� | �����£�pH=12�İ�ˮ��pH=2������������ϣ�c��NH4+����c��Cl-����c��OH-����c��H+�� | |
| D�� | Na2CO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ�pH��KW����С |
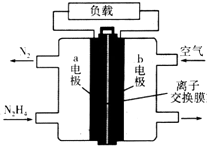 Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص���������ȷ���ǣ�������
Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㣮һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص���������ȷ���ǣ�������| A�� | a���ķ�Ӧʽ��N2H4+4OH--4e-�TN2��+4H2O | |
| B�� | �ŵ�ʱ�����Ӵ�a��������������b�� | |
| C�� | �õ�س����ŵ�ʱ�����ӽ���Ĥ��ѡ�������ӽ���Ĥ | |
| D�� | ��·��ת�Ƶ���3NAʱ��������16.8 L |
| A�� | 16O��18OΪͬ�ֺ��� | |
| B�� | 16O�TC�T18O��16O�TC�T16O��Ϊͬλ�� | |
| C�� | 16O�TC�T18O��16O�TC�T16O�Ļ�ѧ���ʼ�����ȫ��ͬ | |
| D�� | Ŀǰ����ġ���̼���á���Ŀ���������������CO2���ٽ�̼��ƽ�� |
