题目内容
(2011?南京一模)下列各组离子在给定条件下.一定能大量共存的是( )
分析:A.含有大量N0的水溶液中,存在NO3-,离子之间发生氧化还原反应;
B.pH=12的溶液,显碱性,离子之间发生氧化还原反应;
C.含有大量HC03-的澄清透明溶液,显中性;
D.能与铝粉反应生成氢气的溶液,为酸或强碱溶液.
B.pH=12的溶液,显碱性,离子之间发生氧化还原反应;
C.含有大量HC03-的澄清透明溶液,显中性;
D.能与铝粉反应生成氢气的溶液,为酸或强碱溶液.
解答:解:A.含有大量N0的水溶液中,存在NO3-,Fe2+、N03-、H+离子之间发生氧化还原反应,则不能共存,故A错误;
B.pH=12的溶液,显碱性,ClO-、SO32-离子之间发生氧化还原反应,则不能共存,故B错误;
C.含有大量HC03-的澄清透明溶液,显中性,该组离子之间不反应,能大量共存,故C正确;
D.能与铝粉反应生成氢气的溶液,为酸或强碱溶液,碱溶液中OH-、Al3+反应,酸溶液中CH3COOO-、H+结合生成弱电解质,则不能共存,故D错误;
故选C.
B.pH=12的溶液,显碱性,ClO-、SO32-离子之间发生氧化还原反应,则不能共存,故B错误;
C.含有大量HC03-的澄清透明溶液,显中性,该组离子之间不反应,能大量共存,故C正确;
D.能与铝粉反应生成氢气的溶液,为酸或强碱溶液,碱溶液中OH-、Al3+反应,酸溶液中CH3COOO-、H+结合生成弱电解质,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确习题中的信息及离子之间的反应即可解答,注意选项A、B中的氧化还原反应为解答的难点,题目难度不大.

练习册系列答案
相关题目
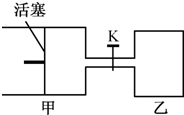 (2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( )
(2011?南京一模)如图所示,向甲和乙两容器中都充入2molX和2molY(K关闭) 起始V甲=0.8aL,V乙=aL,在相同恒定温度下,两容器中各自发生下列反应:X(g)+Y(g)═2Z(g)+W(g),达到平衡时,V甲=0.9aL,则下列说法错误的是( ) 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂