题目内容
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: 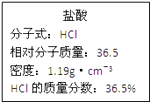
(1)该浓盐酸的物质的量浓度为mol/L.
(2)某学生欲用上述浓盐酸和蒸馏水配制250mL物质的量浓度为0.7mol/L的稀盐酸.
①该学生用量筒量取mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 .
③下列操作导致所配制的稀盐酸物质的量浓度偏低的是(填字母).
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为mol/L.(填选项字母)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]() .
.
【答案】
(1)11.9
(2)14.7;250mL容量瓶;A、B、D
(3)d
【解析】解:(1)该浓盐酸的物质的量浓度为:c= ![]() =
= ![]() mol/L=11.9mol/L,所以答案是:11.9;(2)①配制250mL 0.7mol/L的稀盐酸,配制过程中氯化氢的物质的量不变,则需要11.9mo/L的浓盐酸的体积为:
mol/L=11.9mol/L,所以答案是:11.9;(2)①配制250mL 0.7mol/L的稀盐酸,配制过程中氯化氢的物质的量不变,则需要11.9mo/L的浓盐酸的体积为: ![]() =0.0147L=14.7mL,所以答案是:14.7;②配制250mL 0.7mol/L的稀盐酸,需要选用规格为250mL的容量瓶,配制该溶液还缺少250mL 容量瓶,所以答案是:250mL容量瓶;③A.用量筒量取浓盐酸时俯视凹液面,量取的浓盐酸的体积偏小,配制的溶液浓度偏低,故A正确;B.未恢复到室温就将溶液注入容量瓶并进行定容,配制的溶液体积偏小,溶液浓度偏高,故B错误;C.容量瓶用蒸馏水洗后未干燥,对溶质的物质的量、最终溶液体积无影响,所以不影响配制结果,故C错误;D.定容时仰视液面,配制的溶液体积偏大,溶液浓度偏低,故D正确;E.未洗涤烧杯和玻璃棒,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故E正确;所以答案是:ADE;(3)标准状况下aL气体的物质的量为:
=0.0147L=14.7mL,所以答案是:14.7;②配制250mL 0.7mol/L的稀盐酸,需要选用规格为250mL的容量瓶,配制该溶液还缺少250mL 容量瓶,所以答案是:250mL容量瓶;③A.用量筒量取浓盐酸时俯视凹液面,量取的浓盐酸的体积偏小,配制的溶液浓度偏低,故A正确;B.未恢复到室温就将溶液注入容量瓶并进行定容,配制的溶液体积偏小,溶液浓度偏高,故B错误;C.容量瓶用蒸馏水洗后未干燥,对溶质的物质的量、最终溶液体积无影响,所以不影响配制结果,故C错误;D.定容时仰视液面,配制的溶液体积偏大,溶液浓度偏低,故D正确;E.未洗涤烧杯和玻璃棒,配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故E正确;所以答案是:ADE;(3)标准状况下aL气体的物质的量为: ![]() =
= ![]() mol,该气体得到质量为:36.5g/mol×
mol,该气体得到质量为:36.5g/mol× ![]() mol=
mol= ![]() g,
g,
所得溶液的质量为:1L×1000g/mL+ ![]() g,所得溶液的体积为:
g,所得溶液的体积为: ![]() =
= ![]() L,
L,
所以该溶液的物质的量浓度为:  =
= ![]() mol/L,
mol/L,
所以答案是:d.
【考点精析】本题主要考查了配制一定物质的量浓度的溶液的相关知识点,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线才能正确解答此题.

【题目】下列实验操作能达到实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 制备Fe(OH)3胶体 | 将氨水滴加到饱和FeCl3溶液中 |
B | 配制100mL浓度为 0.1mol·L-1的NaOH溶液 | 称取NaOH固体0.4 g,溶解在100 mL水中 |
C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
D | 除去CO2中少量的HCl | 通过饱和碳酸氢钠溶液 |
A.AB.BC.CD.D
【题目】半导体生产中常需要使用掺杂剂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;②PCl3遇水会强烈水解生成H3PO3和HCl;③PCl3遇O2会生成POCl3,POCl3溶于PCl3;④PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)B中所装的试剂是____________________,F中碱石灰的作用是_____________________________________。
(2)实验时,检査装置气密性后,先打开K3、关闭K1,通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是__________,通过控制K1、K2能除去A、B装置中的空气,具体的操作是________________________________。
(3)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过________(填实验操作名称),即可得到较纯净的PCl3。
(4)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入淀粉作为指示剂
③向其中加入 0.1000 mol·L-1碘水,充分反应,当达到终点时消耗碘水溶液6.9mL。已知:H3PO3+H2O+I2===H3PO4+2HI,假设测定过程中没有其他反应。
滴定时,滴定终点的现象是_________________________________,配制0.1000 mol·L-1的碘水溶液的过程中,下列操作会使所得溶液浓度偏大的是___________
A烧杯中溶液转移至容量瓶中时,未洗涤烧杯
B定容时俯视刻度线
C定容时仰视刻度线
D容量瓶未干燥
E移液时有少量液体溅出
F溶解碘时放热,未冷却至室温就转移至容量瓶并定容
根据上述数据,该产品中PCl3的质量分数为________。



