题目内容
10.对于反应3S+6KOH→2K2S+K2SO3+3H2O,下列说法正确的是( )| A. | S是氧化剂,KOH是还原剂 | |
| B. | 若3mol硫完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是2:1 | |
| D. | 氧化产物和还原产物的质量之比为1:2 |
分析 反应3S+6KOH→2K2S+K2SO3+3H2O中,S元素的化合价由0升高为+4价,由0降低为-2价,以此来解答.
解答 解:A.只有S元素的化合价变化,S既是氧化剂又是还原剂,故A错误;
B.若3mol硫完全反应,1molS为还原剂,则反应中共转移了1mol×(4-0)=4mol电子,故B正确;
C.3mol硫完全反应,1molS为还原剂,2molS作氧化剂,则还原剂与氧化剂的质量比是1:2,故C错误;
D.氧化产物为K2SO3,还原产物为K2S,由反应可知,则氧化产物和还原产物的物质的量之比为1:2,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
16.下列化合物中,同分异构体数目超过7的有(包括自己)( )
| A. | 丁醇 | B. | 乙酸乙酯 | C. | 1,2-二溴丙烷 | D. | 戊烷 |
1.混合气体由CH4和N2组成,测得混合气体在标准状况下的密度为0.893g/L,则混合气体中N2和CH4的体积之比为( )
| A. | 1:1 | B. | 1:4 | C. | 1:2 | D. | 4:1 |
18.现已发现116号元素X,下列关于该元素的说法错误的是( )
| A. | X的最高正化合价为6 | B. | X是金属元素 | ||
| C. | X位于第7周期第ⅥA族 | D. | X为非金属元素 |
5.欲将 转化为
转化为 ,可选用( )
,可选用( )
 转化为
转化为 ,可选用( )
,可选用( )| A. | CO2 | B. | NaHCO3 | C. | NaOH | D. | 盐酸 |
2.我州盛产猕猴桃.猕猴桃富含人体必需微量元素Se.原子序数为34的硒元素的一种同位素80Se 其原子核内的中子数为( )
| A. | 34 | B. | 40 | C. | 46 | D. | 114 |
19.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 电解熔融MgCl2,可制得金属镁 | |
| C. | 在铁制品上镀银时,镀件为阳极,银盐为电镀液 | |
| D. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
20.下列物质①NaHCO3 ②(NH4)2SO4 ③Al2O3 ④(NH4)2CO3 ⑤Mg(OH)2 ⑥Fe(NO3)3中,既可以和盐酸反应也可以和Ba(OH)2溶液反应的是( )
| A. | ①③④ | B. | ①②③④ | C. | ②③④⑥ | D. | ①③④⑤ |

 ;
;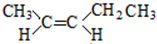 和
和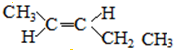 ;
;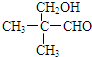 .
.