题目内容
|
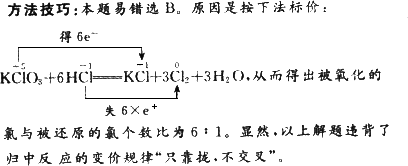
在KClO3+6HCl | |
| [ ] | |
A. |
1∶6 |
B. |
6∶1 |
C. |
1∶5 |
D. |
5∶1 |
答案:D
解析:
解析:
|
解析:同种元素的不同价态间发生氧化还原反应时,高价态和低价态相互反应变为它们相邻的中间价态(即两头变中间,只靠拢,不交叉).KClO3中的氯由+5价被还原为0价.HCl中氯元素被氧化成0价,由电子得失守恒可得被氧化的氯原子(升价的氯)和被还原的氯原子(降价的氯)个数比为5∶1. |

练习册系列答案
相关题目