题目内容
下列关于溶液的酸碱性,说法正确的是( )
| A.pH=7的溶液是中性 |
| B.中性溶液中一定:c(H+)=1.0×10-7 mol·L-1 |
| C.c(H+)=c(OH-)的溶液呈中性 |
| D.在100°C时,纯水的pH<7,因此显酸性 |
C
解析

练习册系列答案
相关题目
已知一定温度下,有下列难溶电解质的相关数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP/250C | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A.向该混合溶液中加过量铁粉,能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C.该混合溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+ c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调pH至3~4后过滤,能得到纯净的CuSO4溶液
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是( )
| A.起始时盐酸和醋酸溶液PH相同 |
B.V(NaOH)=10.00 mL 时, <1 <1 |
| C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多 |
| D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—) |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液。下列说法不正确的是( )
| A.c(NH4+);③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(
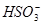 )>c(
)>c(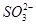 )>c(OH-)
)>c(OH-) 将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
| A.pH=9 | B.c(OH-)≈10-5 mol·L-1 |
| C.pH≈7 | D.c(OH-)<10-7 mol·L-1 |
[双选题]在25℃某稀溶液中,由水电离产生的c(H+)=10-13 mol·L-1,下列有关溶液的叙述正确的是( )
| A.该溶液一定呈酸性 |
| B.该溶液一定呈碱性 |
| C.该溶液的pH可能约为1 |
| D.该溶液的pH可能约为13 |
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HC+H+ HC+H+ |
C.C+H2O HC+OH- HC+OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |