题目内容
已知:2Zn(s)+O2(g) 2ZnO(s) ΔH=-701.0 kJ·mol-1
2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s) ΔH=-181. 6 kJ·mol-1
2HgO(s) ΔH=-181. 6 kJ·mol-1
则反应Zn(s)+HgO(s)==ZnO(s)+Hg(l)的ΔH为
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
C
【解析】
试题分析:已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ·mol-1 ①;
2Hg(l)+O2(g)=2HgO(s) ΔH=-181. 6 kJ·mol-1 ②
①-②得:2Zn(s)+2HgO(s)=2ZnO+2Hg(l) ΔH=-701.0-(-181.6) kJ·mol-1=-519.4 kJ·mol-1
Zn(s)+HgO(s)==ZnO(s)+Hg(l) ΔH=-259.7kJ·mol-1 C正确
考点:考查反应热的计算。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率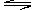 zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是
zC(g),达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的两倍,达到平衡时A的浓度降为0.3mol/L。下列判断正确的是
 O2(g) == H2O(1) △H= ―285.8kJ/mol
O2(g) == H2O(1) △H= ―285.8kJ/mol
 2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大
2NH3(g) ΔH<0,其他条件不变升高温度,平衡时氢气转化率增大