题目内容
2.某有机物的结构为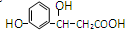 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )| A. | ①⑤⑧ | B. | ①②⑤⑨ | C. | ②⑥⑧⑨ | D. | ②⑤⑧ |
分析 分子中含酚-OH、醇-OH、-COOH,结合酚、醇、羧酸的性质来解答.
解答 解:含酚-OH,可发生氧化、取代反应;
含醇-OH,额发生消去、酯化反应、氧化反应;
含苯环可发生加成反应;
含-OH、-COOH可发生缩聚反应;
不能发生水解、银镜反应及加聚反应,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、醇的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列说法错误的是( )
| A. | 烧碱是强电解质,在水溶液中完全电离,不存在电离平衡 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
17.下列物质中,不含有硅酸盐的是( )
| A. | 水玻璃 | B. | 太阳能电池 | C. | 黏土 | D. | 普通水泥 |

 ,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在.
,若要检验出其中的碳碳双键,方法是先加足量的银氨溶液使醛基氧化,然后再加入酸性的KMnO4溶液,若酸性KMnO4溶液的紫色褪去,证明有碳碳双键存在. 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: