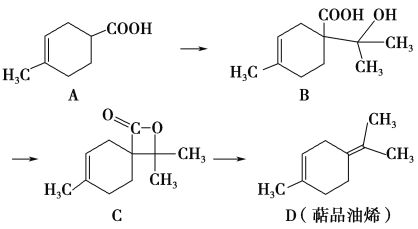
题目内容
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+![]() O2(g)===CO(g) ΔH=-111 kJ·mol1
O2(g)===CO(g) ΔH=-111 kJ·mol1
①该催化重整反应的ΔH=____ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2·L2。下列可判断该反应达到平衡的是_________(填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______(填“>”、“=”或“<”)0。
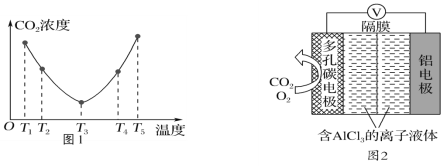
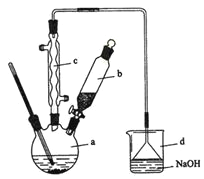
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________。
电池的正极反应式:6O2+6e-=6O;6CO2+6O=3C2O42-+6O2
反应过程中O2的作用是_________________。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
【答案】+247或247 A ![]() 或0.33 D < Al-3e-=Al3+(或2Al-6e-=2Al3+) 催化剂 10
或0.33 D < Al-3e-=Al3+(或2Al-6e-=2Al3+) 催化剂 10
【解析】
(1)①已知:a.C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
b.C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
c.C(s)+![]() O2(g)=CO(g) ΔH=-111 kJ·mol1
O2(g)=CO(g) ΔH=-111 kJ·mol1
将方程式2c-a-b得CH4(g)+CO2(g)═2CO(g)+2H2(g),△H=2×(-111kJ·mol-1)-(-75kJ·mol-1)-(-394kJ·mol-1)=+247kJ·mol-1;
要提高CH4平衡转化率应该使平衡正向移动,但是不能通过增大甲烷浓度实现,该反应的正反应是一个反应前后气体体积增加的吸热反应,升高温度、减小压强能使平衡正向移动,增大甲烷转化率,故选A;
②达到平衡时CO2的转化率是50%,根据方程式知,参加反应的n(CO2)=n(CH4)=1mol×50%=0.5mol,生成的n(CO)=n(H2)=1mol,
CH4(g)+CO2(g)═2CO(g)+2H2(g),
开始(mol·L-1) 1 0.5 0 0
反应(mol·L-1) 0.25 0.25 0.5 0.5
平衡(mol·L-1) 0.75 0.25 0.5 0.5
化学平衡常数K=![]() =
=![]() =1/3;
=1/3;
A.单位时间内生成n mol的CH4,同时生成n mol的H2 ,正逆反应速率不相等,反应未达到平衡,故A错误;
B.v(CH4):v(CO)=1:2,无法确定正逆速率是否相等,故B错误;
C.反应物和生成物均为气体且为恒容容器,容器中气体的密度始终不变,则容器中混合气体的密度不再发生变化,不能用于判断是否达到平衡状态,故C错误;
D.反应前后体积不等,容器中的压强保持不变,能用于判断是否达到平衡状态,故D正确;
故选D。
(2)从c(CO2)的变化趋势可知,开始时减小是没达到平衡,拐点是平衡点,拐点后随温度的升高c(CO2)增大,说明平衡向逆向移动,正反应为放热反应,则△H<0;
(3)该原电池中Al作负极,失电子生成铝离子,电极反应式为Al-3e-=Al3+;在正极的反应式中,氧气在第一个反应中作反应物、在第二个反应中作生成物,所以氧气在反应中作催化剂;
(4)K2=c(CO32-)c(H+)/c(HCO3-)=5×10-11,且所得溶液c(HCO3-):c(CO32-)=2:1,c(H+)=K2·c(HCO3-)/c(CO32-)=5×10-11×2=1×10-10,pH=10。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D