题目内容
 如图所示表示一些元素原子半径规律性的变化示意图.由此图不能得出下列结论的是(不考虑稀有气体元素)( )
如图所示表示一些元素原子半径规律性的变化示意图.由此图不能得出下列结论的是(不考虑稀有气体元素)( )分析:A.由此图可知,电子层数相同的原子(稀有气体除外),原子的半径随原子序数的递增而减小;
B.由此图可知,最外层电子数相同的原子,原子的半径随电子层数的增加而增大;
C.最外层电子数相同,电子层越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小;
D.电子层数多少只是影响原子半径的因素之一,并不是等于多一层电子,原子半径就一定更大,还需考虑核对电子的吸引,核外电子多,相应的核内质子数也多,由于静电作用力增强可能会引起原子半径的减小.
B.由此图可知,最外层电子数相同的原子,原子的半径随电子层数的增加而增大;
C.最外层电子数相同,电子层越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小;
D.电子层数多少只是影响原子半径的因素之一,并不是等于多一层电子,原子半径就一定更大,还需考虑核对电子的吸引,核外电子多,相应的核内质子数也多,由于静电作用力增强可能会引起原子半径的减小.
解答:解:A.当电子层数相同时,核电荷数越大,核对外层电子的吸引力越大,原子半径越小,核电荷数越小,原子半径越大,故A正确;
B.当最外层电子数相同时,处于同一主族,质子数越大,电子层数越多,原子半径就越大,故B正确;
C.当最外层电子数相同,对于F-、Cl-、Br-、I-,电子层数依次增加,离子半径依次增大;K+与Na+、
Mg2+、Al3+比较,K+比它们多1个电子层,故半径大于Na+、Mg2+、Al3+,而对于Na+、Mg2+、Al3+电子层结构相同,核电荷数依次增加离子半径减小,故C正确;
D.原子核对核外电子的吸引,核外电子多,相应的核内质子数也多,静电作用力增强影响原子的半径,电子层数多少只是影响原子半径的因素之一,原子电子层数越多,对应的原子半径不一定大,如由此图可知,K比I少一电子层,但半径K比I大,故D错误;
故选D.
B.当最外层电子数相同时,处于同一主族,质子数越大,电子层数越多,原子半径就越大,故B正确;
C.当最外层电子数相同,对于F-、Cl-、Br-、I-,电子层数依次增加,离子半径依次增大;K+与Na+、
Mg2+、Al3+比较,K+比它们多1个电子层,故半径大于Na+、Mg2+、Al3+,而对于Na+、Mg2+、Al3+电子层结构相同,核电荷数依次增加离子半径减小,故C正确;
D.原子核对核外电子的吸引,核外电子多,相应的核内质子数也多,静电作用力增强影响原子的半径,电子层数多少只是影响原子半径的因素之一,原子电子层数越多,对应的原子半径不一定大,如由此图可知,K比I少一电子层,但半径K比I大,故D错误;
故选D.
点评:本题考查微粒半径大小的比较,掌握微粒大小比较的规律是解题的关键,D、E选项为易错点,题目难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)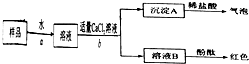 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是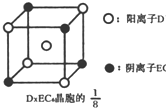
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)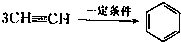 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: