题目内容
12.用NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为11NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
分析 A.标况下庚烷为液体;
B.依据碳正离子CH5+ 的结构计算电子数;
C.16g甲烷的物质的量为1mol,1mol甲烷完全燃烧消耗2mol氧气;
D.1个C3H8含有8个C-H键.
解答 解:A.标况下庚烷为液体,不能使用气体摩尔体积,故A错误;
B.1mol碳正离子CH5+所含电子总数为10NA,故B错误;
C.16个甲烷的物质的量为1mol,完全燃烧1mol甲烷需要消耗氧气2mol,所消耗的氧气的分子数为2NA,故C正确;
D.1个C3H8含有8个C-H键,0.5molC3H8分子中含C-H共价键4NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,注意庚烷标况下不是气体是解题关键,题目难度不大.

练习册系列答案
相关题目
2. 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g.
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是球形冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束后,分离甲醇的操作是蒸馏(或水洗分液).
(4)洗涤操作中,第一次水洗的主要目的是洗掉大部分的硫酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(5)检验产品中是否含有水杨酸的化学方法是向产品中滴加少量的紫色石蕊试液,观察是否变红.
(6)本实验的产率为59%(保留两位有效数字).
 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束后,分离甲醇的操作是蒸馏(或水洗分液).
(4)洗涤操作中,第一次水洗的主要目的是洗掉大部分的硫酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(5)检验产品中是否含有水杨酸的化学方法是向产品中滴加少量的紫色石蕊试液,观察是否变红.
(6)本实验的产率为59%(保留两位有效数字).
3.将3.48g四氧化三铁完全溶解在100mL 1mol•L-1 的硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
| A. | 0.05mol•L-1 | B. | 0.1mol•L-1 | C. | 0.2mol•L-1 | D. | 0.3mol•L-1 |
20.对复杂的有机物结构可用“键线式”表示.如苯丙烯酸丙烯酯: 可简化为:
可简化为: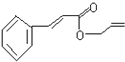 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: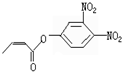 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
 可简化为:
可简化为: 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
17.除去下列物质中的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 溴苯(溴) | 氢氧化钠溶液 | 过滤 |
| B | 苯(甲苯) | 酸性高锰酸钾溶液 | 分液 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴乙烷(乙醇) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
4.等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置片刻后取出,铜片质量比加热前增加的是( )
| A. | 硝酸 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
1.氯气跟碘在加热条件下,以等物质的量进行反应,可得到一种红棕色液体ICl.ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式为:2ICl+2Zn=ZnCl2+ZnI2、ICl+H2O=HCl+HIO,下列叙述中正确的是( )
| A. | ZnCl2既是氧化产物,又是还原产物 | |
| B. | ICl跟H2O的反应是自身氧化还原反应 | |
| C. | ZnI2既是氧化产物,又是还原产物 | |
| D. | 在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂 |
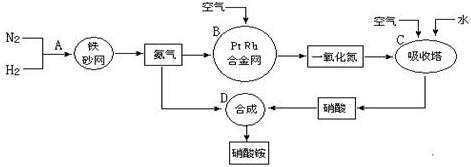
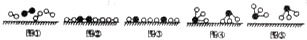
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
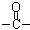 )外,含有的官能团名称是碳碳双键、酯基;
)外,含有的官能团名称是碳碳双键、酯基; .
.