题目内容
14.某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下.提出猜想:
问题1:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题2:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ.解决问题1取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在.根据以上实验现象回答问题.
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:Cu2O+2H+=Cu+Cu2++H2O,
(2)从实验Ⅰ可得出的结论是高温时,+1价的铜比+2价的铜稳定,而溶液中,+2价的铜比+1价的铜稳定
Ⅱ.解决问题2
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01mol X,测得B装置增重0.36g,并收集到0.28g单质气体Y.
(1)X气体的摩尔质量是32g/mol.
(2)C中发生反应的化学方程式为2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O.
分析 Ⅰ.问题1:铁和铜都有变价,具有相似点,正二价铁的稳定性小于正三价的铁,探究正一价铜的稳定性是否也小于正二价的铜,解决问题取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末,继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明高温时,+1价的铜比+2价的铜稳定,取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),Cu2O+2H+=Cu2++Cu+H2O得到蓝色溶液,同时观察到试管底部还有红色固体存在,说明溶液中,+2价的铜比+1价的铜稳定.
(1)根据信息:红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液为+2价的铜盐溶液,同时观察到试管底部还有红色固体存在为铜单质,据此书写化学方程式;
(2)根据信息:氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末为氧化铜;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明高温+1价铜稳定;
Ⅱ.A中碱石灰可吸收水蒸气,C中N2H4和氧化铜反应:2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O,无水硫酸铜遇水变蓝,可检验水,吸收水,B装置增重0.36g,即生成0.02mol的水,单质气体Y为氮气.
(1)根据原子守恒确定气态氢化物的化学式,计算摩尔质量;
(2)根据实验现象来书写化学方程式.
解答 解:Ⅰ.问题1:铁和铜都有变价,具有相似点,正二价铁的稳定性小于正三价的铁,探究正一价铜的稳定性是否也小于正二价的铜,解决问题取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末,继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,说明高温时,+1价的铜比+2价的铜稳定,取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),Cu2O+2H+=Cu2++Cu+H2O得到蓝色溶液,同时观察到试管底部还有红色固体存在,说明溶液中,+2价的铜比+1价的铜稳定.
(1)根据信息:红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液为+2价的铜盐溶液,同时观察到试管底部还有红色固体为铜单质,Cu2O中+1价的铜在酸性溶液中发生氧化还原反应:Cu2O+2H+=Cu+Cu2++H2O,
故答案为:Cu2O+2H+=Cu+Cu2++H2O;
(2)根据信息:氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜,根据在不同温度下反应物的组成可确定物质的稳定性,所以高于1000℃时Cu2O比CuO稳定,在溶液中:Cu2O+2H+=Cu+Cu2++H2O,所以Cu2+比Cu+稳定,
故答案为:高温时,+1价的铜比+2价的铜稳定,而溶液中,+2价的铜比+1价的铜稳定;
Ⅱ.(1)消耗0.01mol X,测得B装置增重0.36g,即生成0.02mol的水,并收集到单质气体Y 0.28g即氮气0.01mol,根据原子守恒可以确定气态氢化物X中含有4个氢原子和2个氮原子,X的化学式为N2H4,其摩尔质量为32g/mol,
故答案为:32g/mol;
(2)C中发生反应的化学方程式为N2H4和氧化铜反应:2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O,
故答案为:2CuO+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2↑+2H2O.
点评 本题考查实验探究和数据处理,做题时注意变价金属氧化物的性质以及质量守恒定律计算物质的化学式.题目难度中等.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
 乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下:
乙酸异戊脂是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图图1和有关数据如下: +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$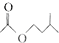 +H2O
+H2O| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙醇 | 60 | 1.0492 | 118 | 溶 |
| 乙醇异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.回答下列问题:

(1)装置B的名称是:球形冷凝管
(2)在洗涤操作中,第一次水洗的主要目的是:洗掉大部分硫酸和醋酸; 第二次水洗的主要目的是:洗掉碳酸氢钠
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后D(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:提高醇的转化率
(5)实验中加入少量无水硫酸镁的目的是:干燥乙酸异戊酯;
(6)在蒸馏操作中,如图2仪器选择及安装都正确的是:b(填标号)
(7)本实验的产率是:C
A.30% B.40% C.50% D.60%
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏高(填高或者低)原因是会收集少量的未反应的异戊醇.
| A. | K+、Na+、SO42-、Mn2+ | B. | Cl-、S2-、Fe2+、H+ | ||
| C. | Na+、Ba2+、Br-、CO32- | D. | Na+、H+、NO3-、HCO3- |
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △G<0的反应是自发的,因此在任何条件均可发生 |
| A. | SO2的摩尔质量是64g | |
| B. | 1molSO2中所含分子数约为6.02×1023 | |
| C. | 1molSO2的质量是64g/mol | |
| D. | 常温常压下,1mol SO2的体积为22.4L |
 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: 如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题:
如图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号,请回答下列问题: