题目内容
11.下列叙述正确的是( )| A. | 常温下1L0.1mol/LNH4Cl溶液与2L0.05mol/LNH4Cl溶液中c(NH4+)相等 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4NO3溶液中,c(H+)相等 | |
| C. | pH=6的CH3COOH和CH3COONa混合液中:c(Na+)+c(OH-)-c(CH3COO-)=10-6mol/L | |
| D. | pH=9的NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)>c(H+) |
分析 A.溶液浓度不同,铵离子水解程度不同;
B.根据溶液酸碱性与溶液pH的计算表达式分析;
C.根据混合液中的电荷守恒判断;
D.NaHA溶液的pH=9,溶液显示碱性,则c(OH-)>c(H+),说明HA-的水解程度大于其电离程度,则c(H2A)>c(A2-),由于溶液中的氢氧根离子、氢离子还来自水的电离,则c(OH-)>c(H2A)、c(H+)>c(A2-).
解答 解:A.常温下1L0.1mol/LNH4Cl溶液与2L0.05mol/LNH4Cl溶液中,氯化铵浓度不同,铵离子水解程度不同,所以所含NH4+的物质的量相不同,故A错误;
B.溶液的pH=-lgc(H+),则两溶液中氢离子浓度都是1×10-5mol/L,氢离子浓度相等,故B正确;
C.pH=6的CH3COOH和CH3COONa混合液中,根据电荷守恒可得:c(H+)=c(Na+)-c(OH-)-c(CH3COO-)=10-6mol/L,故C错误;
D.pH=9的NaHA溶液呈碱性,c(OH-)>c(H+),说明HA-的水解程度大于其电离程度,则c(H2A)>c(A2-),由于溶液中的氢氧根离子、氢离子还来自水的电离,则c(OH-)>c(H2A)、c(H+)>c(A2-),溶液中正确的离子浓度大小为:c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其应用为解答关键,注意掌握电荷守恒、物料守恒等知识在判断各离子浓度大小中的应用方法.

练习册系列答案
相关题目
1.甲烷在隔绝空气加强热时可分解为C2H2和H2,若有80%CH4按上述形式分解,所得混合气体的密度是相同条件下氢气密度的倍数是( )
| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
3.下列叙述正确的是( )
| A. | 在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 | |
| B. | 同温同压下,4Al(s)+3O2(g)═2Al2O3(s)在常温和点燃条件下的△H不同 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-53.7KJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ | |
| D. | 需要加热的化学反应一定是吸热反应 |
20.一定条件下,将A、B、C三种物质各1mol通入一个密闭容器中发生反应:2A+B?2C,达到化学反应限度时,B的物质的量可能是( )
| A. | 1.5 mol | B. | 1 mol | C. | 0.5 mol | D. | 0 |
 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A~F为短周期主族元素,G为第四周期元素.已知:A是原子半径最小的元素,B和D同周期,固态的BD2能升华,E、F在B、D的下一周期,且E原子的最外层电子数与次外层电子数之比为3:4;G的质子数比F多12.请回答: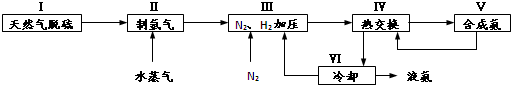
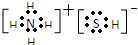 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
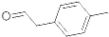
 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(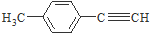 )的一条路线如下:
)的一条路线如下: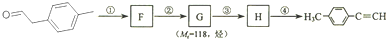
 分子中一定在同一平面的原子数为12个;
分子中一定在同一平面的原子数为12个; 分子中在同一直线上的原子数最多有6个;
分子中在同一直线上的原子数最多有6个;