题目内容
把足量的铁粉投入硫酸和硫酸铜的混合液中,充分反应后,所得金属粉末的质量与加入的铁粉的质量相等.求原混合液中H+和SO42-的物质的量之比.
答案:
解析:
解析:
| 1∶4解析:方法一:设H2SO4、CuSO4、Fe的物质的量为x、y、z.
Fe+H2SO4====FeSO4+H2↑ 1mol 1mol x x Fe+CuSO4====FeSO4+Cu 1mol 1mol 1mol y y y 由题意得:Fe粉加入前质量=生成铜的质量+剩余铁粉的质量. 即56g/mol×z=64g/mol×y+56g/mol×(z-x-y) 解得:y=7x 所以有 方法二:设H2SO4、CuSO4的物质的量分别为x、y. Fe + H2SO4====FeSO4+H2↑ 1mol 1mol x x Fe + CuSO4====FeSO4+Cu 1mol 1mol 1mol y y y 由题意知:减少的质量与增加的质量相等 56x+56y=64y 所以有y=7x
|

练习册系列答案
相关题目
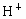 与
与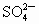 的物质的量之比为
的物质的量之比为 与
与 的物质的量之比为
的物质的量之比为 与
与 的物质的量之比为
的物质的量之比为