题目内容
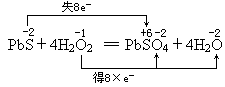
油画所用颜料含有某种白色铅化合物,置于空气中,长时间后会生成黑色的PbS,从而使油画的色泽变暗.若用H2O2来“清洗”,则可将PbS转变成PbSO4,而使油画复原,回答:
(1)上述清洗反应的化学方程式为:________.
(2)若有0.1mol PbS参加反应,则在反应中转移的电子为________mol.
答案:PbS+4H2O2=PbSO4+4H2O;0.8
解析:
提示:
解析:
|
【答案】(1)PbS+4H2O2=PbSO4+4H2O;(2)0.8 【解析】此题考查的知识点包括氧化还原反应的书写、配平和计算.由题知此反应为H2O2将PbS氧化为PbSO4,H2O2自身被还原为H2O.将化学方程式写好并配平后分析电子的得失,当有1个PbS反应时电子转移了8个.
|
提示:
|
【方法提炼】在解反应物质与转移电子的数量关系的计算时,应先根据化学方程式,分析电子转移的数目与物质的系数之间的关系,从而应用此关系解题. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目