题目内容
下列表示对应化学反应的离子方程式正确的是( )
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、向200mL 2mol/L溴化亚铁溶液中通入11.2L的标况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- |
| C、向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O |
| D、酸性KMnO4溶液吸收SO2:MnO4-+4H++SO2═Mn2++SO42-+2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.二者反应生成碳酸钙和次氯酸;
B.n(FeBr2)=2mol/L×0.2L=0.4mol,n(Cl2)=
=0.5mol,二者反应时,氯气先氧化亚铁离子后氧化溴离子;
C.碳酸氢铵和过量氢氧化钠溶液反应生成碳酸钠、氨气和水;
D.电荷不守恒.
B.n(FeBr2)=2mol/L×0.2L=0.4mol,n(Cl2)=
| 11.2L |
| 22.4L/mol |
C.碳酸氢铵和过量氢氧化钠溶液反应生成碳酸钠、氨气和水;
D.电荷不守恒.
解答:
解:A.二者反应生成碳酸钙和次氯酸,离子方程式为Ca 2++2ClO-+CO2+H2O═2HClO+CaCO3↓,故A错误;
B.n(FeBr2)=2mol/L×0.2L=0.4mol,n(Cl2)=
=0.5mol,二者反应时,氯气先氧化亚铁离子后氧化溴离子,氯气完全反应得到1mol电子,亚铁离子完全反应需要0.4mol电子,溴离子完全被氧化需要0.8mol电子,根据得失电子守恒知,有一半的溴离子不参加反应,所以离子方程式为4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl-,故B正确;
C.碳酸氢铵和过量氢氧化钠溶液反应生成碳酸钠、氨气和水,离子方程式为NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O,故C错误;
D.电荷不守恒,离子方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故D错误;
故选B.
B.n(FeBr2)=2mol/L×0.2L=0.4mol,n(Cl2)=
| 11.2L |
| 22.4L/mol |
C.碳酸氢铵和过量氢氧化钠溶液反应生成碳酸钠、氨气和水,离子方程式为NH4++HCO3-+2OH-
| ||
D.电荷不守恒,离子方程式为2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故D错误;
故选B.
点评:本题考查了离子方程式的书写,明确物质之间反应实质是解本题关键,A中注意酸性强弱顺序,难点是B,注意离子反应先后顺序及反应的量,为易错点.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
下列有关物质性质的应用正确的是( )
| A、石英坩埚耐高温,可用来加热熔化NaOH固体 |
| B、浓硫酸有脱水性,可用作干燥剂 |
| C、二氧化硫有漂白性,可大量用于加工食品使食品漂白 |
| D、医用酒精能使蛋白质变性,可用来消毒杀菌 |
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、常温常压下1mol N02气体与水反应生成NA个N03-离子 |
| B、在1L 0.2mol/L的硫酸铁溶液中含有的Fe3+数为0.4NA |
| C、标准状况下,3.36L丁烷中含有的非极性键数为0.6NA |
| D、1mol KHSO4熔融态中含有离子总数为2NA |
下列各组离子能在指定环境中大量共存的是( )
| A、在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ |
短周期元素A、B、C、D的原子序数依次增大.A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,元素D位于第ⅥA族.下列说法正确的是( )
| A、原子半径:D>B>C>A |
| B、元素A、B的氧化物所含化学键的类型完全相同 |
| C、元素B和C的最高价氧化物对应水化物的碱性:B<C |
| D、元素B、C、D的最高价氧化物对应的水化物能相互反应 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1mol/L的NaOH溶液:K+、AlO2-、SO42-、CO32- | ||
| B、0.1mol/LFeCl3溶液:K+、NH4+、I-、SCN- | ||
| C、0.1mol/L的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | ||
D、
|
下列各离子浓度的比较,正确的是( )
| A、0.1mol?L-1 CH3COONa溶液中:c(OH-)>c(CH3COOH)+c(H+) |
| B、0.1mol?L-1的NH4Cl溶液与0.05mol?L-1的NaOH溶液等体积混合后溶液显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H+) |
| D、1.0L 0.3mol?L-1 NaOH溶液缓慢通入CO2气体至溶液增重8.8g,所得溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+) |
下列反应对应的离子方程式书写正确的是( )
| A、用氢氟酸在玻璃上“刻字”:SiO2+4H++4F-═SiF4↑+2H2O |
| B、实验室制取氯气:2MnO4-+8H++6Cl-═2MnO2↓+3Cl2↑+4H2O |
| C、将铁粉放入硫酸铁和硫酸铜的混合溶液中,初始阶段发生的反应:Fe+2Fe3+═3Fe2+ |
| D、常温下,铁与过量的浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
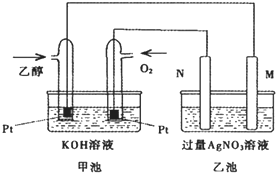 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: