题目内容
根据元素周期表进行分析判断,下列叙述不正确的是( )
| A、第15列元素的最高价氧化物为R2O5 |
| B、第三周期元素的离子半径,从左到右逐渐减小 |
| C、同周期第ⅡA族与第ⅢA族的元素原子序数之差可能为1或11或25 |
| D、只含有非金属元素的化合物不一定是共价化合物 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A.第15列元素为ⅤA族元素,最高价为+5价;
B.第三周期元素的离子半径,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
C.第ⅡA族与第ⅢA族的元素,短周期相差1、4和5周期相差11、6和7周期相差25;
D.只含有非金属元素的化合物,可能为离子化合物.
B.第三周期元素的离子半径,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
C.第ⅡA族与第ⅢA族的元素,短周期相差1、4和5周期相差11、6和7周期相差25;
D.只含有非金属元素的化合物,可能为离子化合物.
解答:
解:A.第15列元素为ⅤA族元素,最高价为+5价,则最高价氧化物为R2O5,故A正确;
B.第三周期元素的离子半径,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,所以第三周期元素的离子半径中阴离子半径大于阳离子半径,且铝离子半径最小,故B错误;
C.第ⅡA族与第ⅢA族的元素,原子序数之差在短周期相差1(相邻)、4和5周期相差11(中间为副族和第ⅤⅢ族)、6和7周期相差25(中间为副族和第ⅤⅢ族且含锕系和镧系),故C正确;
D.只含有非金属元素的化合物,可能为离子化合物,如铵盐,故D错误;
故选A.
B.第三周期元素的离子半径,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,所以第三周期元素的离子半径中阴离子半径大于阳离子半径,且铝离子半径最小,故B错误;
C.第ⅡA族与第ⅢA族的元素,原子序数之差在短周期相差1(相邻)、4和5周期相差11(中间为副族和第ⅤⅢ族)、6和7周期相差25(中间为副族和第ⅤⅢ族且含锕系和镧系),故C正确;
D.只含有非金属元素的化合物,可能为离子化合物,如铵盐,故D错误;
故选A.
点评:本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,选项BC为解答的易错点,把握规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
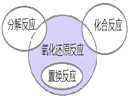 氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分
氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是( )
| A、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
B、4NH3+5O2
| ||||
| C、2NaHCO3=Na2CO3+H2O+CO2↑ | ||||
| D、Cl2+2NaBr=2NaCl+Br2 |
下列卤代烃,既能发生水解反应,又能发生消去反应的是( )


| A、①② | B、③④ | C、②④ | D、①③ |
固体熔化时,必须破坏非极性共价键的是( )
| A、冰 | B、晶体硅 | C、溴 | D、二氧化硅 |
从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )
| A、溴离子具有氧化性 |
| B、氯气是还原剂 |
| C、该反应属于复分解反应 |
| D、氯气是氧化剂 |
下列各指定微粒的数目比不是1:1的是( )
| A、Na2O2晶体中阴离子和阳离子 | ||
| B、NaHSO4晶体中阳离子和阴离子 | ||
C、
| ||
| D、氯化钠中的质子总数和电子总数 |
下列电子式正确的是( )
A、 |
B、 |
C、 |
D、二氧化碳 |
下列有关金属晶体的堆积模型的说法正确的是( )
| A、金属晶体中的原子在二维空间有三种放置方式 |
| B、金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6 |
| C、镁型堆积和铜型堆积是密置层在三维空间形成的两种堆积方式 |
| D、金属晶体中的原子在三维空间的堆积有多种方式,其空间的利用率相同 |
在含有I-且能使酚酞变红的无色溶液中,可大量存在的离子组是( )
| A、Na+、Cu2+、Br-、Cl- |
| B、AlO2-、K+、NH4+、Na+ |
| C、K+、Na+、NO3-、H+ |
| D、K+、S2-、SO42-、OH- |