题目内容
20.0.1mol铁粉与含0.1molFe2(SO4)3的溶液混合后充分后应,下列叙述正确的是( )| A. | 氧化产物为0.1mol | B. | 还原产物为0.1mol | ||
| C. | 氧化产物和还原产物共0.2mol | D. | 氧化产物为0.2mol |
分析 n(Fe3+)=0.2mol,与铁粉发生Fe+2Fe3+=3Fe2+,反应中铁粉为还原剂,Fe3+为氧化剂,Fe2+既是氧化产物也是还原产物,以此解答该题.
解答 解:n(Fe3+)=0.2mol,与铁粉发生Fe+2Fe3+=3Fe2+,0.1mol铁与硫酸铁完全反应,反应中铁粉为还原剂,Fe3+为氧化剂,Fe2+既是氧化产物也是还原产物,
则氧化产物为0.1mol,还原产物为0.2mol,氧化产物和还原产物共0.3mol,只有A正确.
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应及反应的离子方程式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列分离方法中不正确的是( )
| A. | 利用萃取方法用四氯化碳提取溴水中的溴单质 | |
| B. | 利用蒸馏的方法可以分离沸点相差较大的液体混合物 | |
| C. | 利用结晶的方法除去KNO3中的氯化钠 | |
| D. | 利用分液的方法分离酒精和水 |
8.下列表述正确的是( )
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: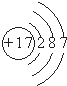 | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
15.下列实验方案,不能达到相应的实验目的是( )
| A | B | C | D | |
| 实验方案 |  |  |  |  加热大试管,一段时间后,蒸发皿中产生肥皂泡,点燃 |
| 目的 | 探究反应物浓度对化学平衡的影响 | 证明MnO2作该反应的催化剂 | 干燥并收集氨气 | 探究铁与水蒸气能否反应 |
| A. | A | B. | B | C. | C | D. | D |
10.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,
反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3,平衡常数为K3.
请结合表中在不同温度下K1、K2的值,回答下列问题:
(1)反应①的平衡常数表达式K1=$\frac{[CO]}{[C{O}_{2}]}$,△H>0(填“>”、“<”或“=”).
(2)根据反应①与②推导出Q1、Q2、Q3的关系式:Q3=Q3=Q1-Q2.计算出在1173K时反应③的平衡常数K3的数值:K3=1.4.
(3)能判断反应③已达到化学平衡状态的依据是CD.
A.容器中压强不变 B.△H不变 C.v正(H2)=v逆(CO) D.CO的质量分数不变.
反应②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2的平衡常数为K2,
反应③H2(g)+CO2(g)?CO(g)+H2O(g)△H=Q3,平衡常数为K3.
请结合表中在不同温度下K1、K2的值,回答下列问题:
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.20 | 1.50 |
(2)根据反应①与②推导出Q1、Q2、Q3的关系式:Q3=Q3=Q1-Q2.计算出在1173K时反应③的平衡常数K3的数值:K3=1.4.
(3)能判断反应③已达到化学平衡状态的依据是CD.
A.容器中压强不变 B.△H不变 C.v正(H2)=v逆(CO) D.CO的质量分数不变.
7.实验室保存下列化学试剂的方法正确的是( )
| A. | 水玻璃保存在带磨口玻璃塞的试剂瓶中 | |
| B. | 少量金属钠可保存在煤油中,大量的金属钠可保存在液体石蜡中 | |
| C. | 氢氟酸保存在磨口试剂瓶中 | |
| D. | 液溴密封盛放在无色试剂瓶中,并在液面上放一层水 |
8.下列各组溶液间的反应,可用同一个离子方程式表示的是( )
| A. | 盐酸与碳酸钠,盐酸与碳酸钙 | |
| B. | 氯化钡与硫酸钠,氢氧化钡与硫酸镁 | |
| C. | 氢氧化钠与盐酸,氢氧化钠与醋酸 | |
| D. | 硝酸钙与碳酸钠,氯化钙与碳酸钾 |