��Ŀ����
(1)��(N2H4)�ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��32. 0gN2H4����������ȫȼ�����ɵ������ų�����624kJ (25��ʱ)��N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ��___ ��
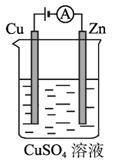
(2)��ͼ��һ���绯ѧ����ʾ��ͼ����пƬ�Ϸ����ĵ缫��Ӧ��___��
�ڼ���ʹ����һ����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ�������仯128g������һ����ȼ�ϵ���ڴ˱仯���������������ı�״���µĿ���____L(��������������������Ϊ20%)��
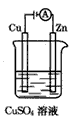
(2)��ͼ��һ���绯ѧ����ʾ��ͼ����пƬ�Ϸ����ĵ缫��Ӧ��___��
�ڼ���ʹ����һ����ȼ�ϵ����Ϊ�������еĵ�Դ��ͭƬ�������仯128g������һ����ȼ�ϵ���ڴ˱仯���������������ı�״���µĿ���____L(��������������������Ϊ20%)��
(3)��ͳ�Ʊ��µķ���������NaClO����NH3���Ƶ��µ�ϡ��Һ���÷�Ӧ�����ӷ���ʽ��____ ��
(1)N2H4(l)+O2(g)==N2(g)+2H2O(l) ��H=-624kJ/mol
(2)��Cu2++2e-==Cu����112
(3)ClO-+2NH3==N2H4+Cl-+H2O
(2)��Cu2++2e-==Cu����112
(3)ClO-+2NH3==N2H4+Cl-+H2O

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ