题目内容
6.铬酸铅(PbCrO4)俗称铬黄,不溶于水.广泛用于涂料、油墨等工业.实验室模拟工业上用含铬废料(含有Cr2O3、Fe2O3、C、Si等)来制备铬黄的工艺流程如下: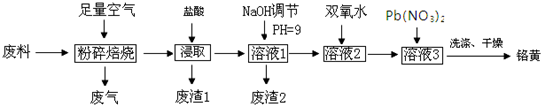
已知:Cr2O3与氧气不反应,化学性质与氧化铝类似,溶液2成分之一为NaCrO2,溶液3成分之一为Na2CrO4
(1)粉碎的目的是增加反应物间的接触面积,加快反应速率
(2)废渣1的主要成分是SiO2
(3)已知Fe(OH)3的Ksp=4×10-38,则在溶液1残留的c(Fe3+)=4x10-23mol/L
(4)写出生成NaCrO2的离子方程式Cr2O3+2OH-=2CrO2-+H2O
(5)溶液2中加入双氧水发生反应的离子方程式2OH-+2CrO2-+3H2O2=2CrO42-+4H2O
(6)检验铬黄洗涤干净的操作方法是取最后洗涤液少量于试管中,滴加硝酸银溶液,若不出现白色沉淀,则洗涤干净.
分析 流程分析可知,铬废料(主要成分为Cr2O3,杂质为Fe2O3、Al2O3、C、SiO2)为原料粉碎焙烧除去碳,后在反应器中加入浓盐酸浸取,因二氧化硅不反应,经过滤可得到废渣Ⅰ为二氧化硅,溶液1中含有Fe3+、Al3+、Cr3+等,加入氢氧化钠溶液调节pH=9,可除去Fe3+、Al3+,得到的废渣2为Al(OH)3和Fe(OH)3,在CrO22-溶液2中加入过氧化氢,经氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;
(2)上述分析可知,滤渣1的主要成分是二氧化硅;
(3)Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4×10-38,溶液PH=9铁滤渣沉淀完全,据此计算;
(4)Cr2O3与氧气不反应,化学性质与氧化铝类似,Cr2O3 与强碱溶液反应生成NaCrO2;
(5)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水;
(6)检验沉淀是否完全的方法是:取最后一次洗涤液,滴加AgNO3溶液,无沉淀生成,说明沉淀完全.
解答 解:铬废料(主要成分为Cr2O3,杂质为Fe2O3、Al2O3、C、SiO2)为原料粉碎焙烧除去碳,后在反应器中加入浓盐酸浸取,因二氧化硅不反应,经过滤可得到废渣Ⅰ为二氧化硅,溶液1中含有Fe3+、Al3+、Cr3+等,加入氢氧化钠溶液调节pH=9,可除去Fe3+、Al3+,得到的废渣2为Al(OH)3和Fe(OH)3,在CrO22-溶液2中加入过氧化氢,经氧化可得到CrO42-溶液,然后加入Pb(NO3)2溶液,可得到PbCrO4沉淀,
(1)将铬污泥粉碎可以增大与盐酸的接触面积,加快反应速率,有利于提高浸取率,故答案为:增加反应物间的接触面积,加快反应速率;
(2)滤渣1的主要成分是二氧化硅,故答案为:SiO2;
(3)Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4×10-38,调节溶于PH=9,c(OH-)=10-5mol/L,则在溶液1残留的c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{4×1{0}^{-38}}{(1{0}^{-5})^{3}}$=4×10-23mol/L,
故答案为:4×10-23mol/L;
(4)Cr2O3与氧气不反应,化学性质与氧化铝类似,Cr2O3 与强碱溶液反应生成NaCrO2,反应的离子方程式为:Cr2O3+2OH-=2CrO2-+H2O,
故答案为:Cr2O3+2OH-=2CrO2-+H2O;
(5)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(6)检验铬黄洗涤干净的操作方法是:取最后的一次洗涤液,滴加AgNO3溶液,无沉淀生成,说明沉淀完全;
故答案为:取最后洗涤液少量于试管中,滴加硝酸银溶液,若不出现白色沉淀,则洗涤干净.
点评 本题考查物质的分离、提纯的综合应用,为高考常见题型,侧重于学生的分析能力和实验能力的考查,本题注重溶度积常数的计算、离子的检验、氧化还原反应等知识点,难度不大,离子的检验是高考的热点,注意离子方程式的书写.

| A. | K+、Al3+、CO32-、Cl- | B. | Na+、H+、SO42-、SiO32- | ||
| C. | H+、NH4+、SO42-、I- | D. | H+、Fe2+、Cl-、ClO- |
| 初始浓度/(mol•L-1) | 初始速率/mol•L-1s-1 | |
| c(NO) | c(O2) | |
| 0.010 | 0.010 | 2.5×10-3 |
| 0.010 | 0.020 | 5.0×10-1 |
| 0.030 | 0.020 | 4.5×10-2 |
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
(1)反应的△H小于0(填“大于”或“小于”)判断的理由是反应Ⅰ、Ⅲ起始量相同,Ⅰ的CH3OCH3(g)含量低,说明降温正向移动,正反应为放热过程△H<0,容器Ⅰ到达平衡所需的时间为20min反应速率v(CH2OH)为0.004mol•L-1•min-1,列式求算387℃时该反应的平衡常数K1=4
(2)容器Ⅱ达平衡时,压强是容器Ⅰ的两倍,CH3OH的体积分数和容器Ⅰ中的相同,CH3OH起始的物质的量为0.40mol;平衡时CH3OCH3(g)的体积分数为0.4
(3)t分钟后容器Ⅲ达到平衡,t大于20min(填“大于”、“等于”或“小于”)判断的理由是温度越低,反应速率越小,达到平衡时所需的时间越长请在图中分别画出容器Ⅰ和容器Ⅱ中CH3OH(g)浓度变化的曲线示意图

(4)208℃,若向3L容器中充入0.9molCH3OH(g),0.6molCH3OCH3(g)和0.3molH2O(g),则起始时该反应的v正>v逆(填“>”“<”或“=”)
| A. | C2H6 | B. | C4H6 | C. | C5H10 | D. | CH4 |
| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 降低温度 | D. | 锌片改为锌粉 |

 .
. .
.