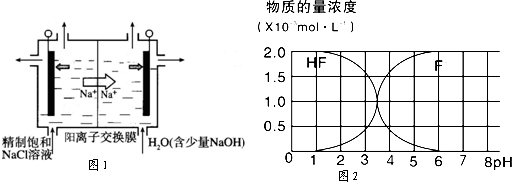
题目内容
二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。

(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ,氧化产物与还原产物的物质的量之比为 。
(2)控制水浴温度在60~80℃之间的目的是 ,图示装置中缺少的一种必须的玻璃仪器是 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的化学方程式 。
(1)2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O,1︰1。
2ClO2↑+2CO2↑+2KHSO4+2H2O,1︰1。
(2)使反应正常进行,并防止温度过高引起爆炸。温度计。(3)②
(4)5H2S+8ClO2+4H2O=5SO42—+8Cl—+18H+
【解析】
试题分析:(1)根据提示可知反应的方程式为2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O。氧化产物和还原产物的物质的量之比为1:1。
2ClO2↑+2CO2↑+2KHSO4+2H2O。氧化产物和还原产物的物质的量之比为1:1。
(2)如果温度过高,会引起爆炸,缺少的必要玻璃仪器是温度计。
(3)因为二氧化氯水溶液温度过高会引起爆炸,所以应该用冰水来吸收。
(4)根据提示可知该反应的方程式为:5H2S+8ClO2+4H2O=5SO42-+8Cl-+18H+。
考点:性质与制备实验
点评:本题主要考查学生获得信息的能力和实验分析能力。

 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.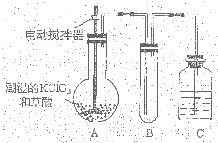 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: