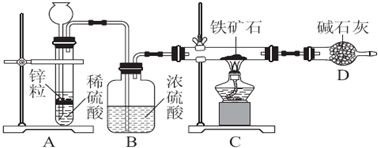
题目内容
1.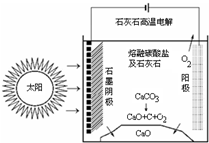 CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:(1)上述生产过程的能量转化方式是太阳能和电能转化为化学能.
(2)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极的电极反应式为3CO2+4e-═C+2CO32-.
分析 (1)依据图示可知是太阳能和电能转化为化学能的变化过程;
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,阴极是二氧化碳得到电子生成碳,依据电子守恒和传导离子配平书写电极反应.
解答 解:(1)依据图示可知是太阳能和电能转化为化学能的变化过程,故答案为:太阳能和电能转化为化学能;
(2)述电解反应在温度小于900℃时进行碳酸钙先分解为Ca0和CO2,电解质为熔融碳酸钠,则阳极的电极反应是碳酸根离子失电子生成氧气的过程,电极反应为:2CO32--4e-═2CO2↑+O2↑,阴极是二氧化碳得到电子生成碳,依据电子守恒和传导离子配平书写电极反应为:3CO2+4e-═C+2CO32-;
故答案为:3CO2+4e-═C+2CO32-.
点评 本题考查原电池原理的应用知识,题目难度不大,注意知识的迁移应用是关键.

练习册系列答案
相关题目
12.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 己烷和苯 | B. | 乙烯和乙炔 | C. | 乙醇和乙醛 | D. | 甲苯和苯 |
16.2015年9月28日美国宇航局公布了火星地表存在液态水的重大发现,下列有关水的说法正确的是( )
| A. | 水属于氧化物 | B. | 水分子中含有非极性键 | ||
| C. | 冰与可燃冰的化学成分完全相同 | D. | 氟气与水的反应中,水作氧化剂 |
13.元素X、Y、Z、W、M、N的原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者的原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,Z2X4可以作火箭燃料,X2W2为18电子分子.均含X、W、M、N四种元素的两种常见化合物相互反应有带刺激性气味的气体放出.下列叙述错误的是( )
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
10.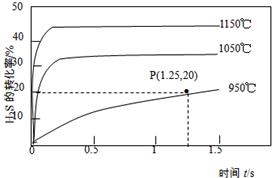 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
 硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(s)═S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)<v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
11.X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构.下列说法正确的是( )
| X | Y | Z | |
| 原子半径/nm | 0.154 | 0.130 | 0.071 |
| A. | 原子最外层电子数:Z>X>Y | B. | 三种元素可能为同周期元素 | ||
| C. | 原子序数:Y>X>Z | D. | 离子半径:X>Y>Z |