题目内容
4.某化合物由五种短周期元素组成,分别为X、Y、Z、W、R,原子序数依次增大.X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料.下列说法正确的是( )| A. | Z与Y形成的化合物是工业上制取Z的原料 | |
| B. | WY2可与酸反应,但不能与碱反应 | |
| C. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| D. | 热稳定性:X2R>X2Y |
分析 X、Y、Z、W、R的原子序数依次增大.X原子是所有原子中半径最小的,则X为H元素;Y原子的最外层电子数是次外层的3倍,则Y的次外层电子数为2、最外层电子数为6,可知Y为O元素,Y、R同主族,则R为S元素;Z、W、R同周期,Z是常见的金属,电子层数等于主族序数,则Z为Al,W单质是人类将太阳能转变为电能的常用材料,W为Si,然后结合元素周期律及元素化合物知识来解答.
解答 解:X、Y、Z、W、R的原子序数依次增大.X原子是所有原子中半径最小的,则X为H元素;Y原子的最外层电子数是次外层的3倍,则Y的次外层电子数为2、最外层电子数为6,可知Y为O元素,Y、R同主族,则R为S元素;Z、W、R同周期,Z是常见的金属,电子层数等于主族序数,则Z为Al,W单质是人类将太阳能转变为电能的常用材料,W为Si,
A.Z与Y形成的化合物为Al2O3,工业上电解熔融氧化铝制取Al,故A正确;
B.SiO2可与HF酸反应,也能与碱反应,故B错误;
C.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径按X、Y、R、W、Z的顺序依次增大,故C错误;
D.非金属性O>S,则热稳定性:X2R<X2Y,故D错误;
故选A.
点评 本题考查原子结构及元素周期律,为高频考点,把握原子结构、元素的位置及元素化合物性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
15.根据不同部位工作条件的不同,航天飞机使用了多种防热材料.例如,机身和机翼下表面使用高温陶瓷瓦.下列对新型陶瓷材料的有关叙述中,错误的是( )
| A. | 高温结构陶瓷属于新型无机非金属材料,可以作为高级耐火材料 | |
| B. | 氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷 | |
| C. | 氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面 | |
| D. | 新型无机非金属材料克服了传统无机非金属材料的缺点,但是强度比较差 |
12.已知:H2(g)+F2(g)→2HF(g)+270KJ,下列说法正确的是( )
| A. | 2L氟化氢气体分解成1L氟气与1L氢气吸收270KJ热量 | |
| B. | 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270KJ | |
| C. | 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 | |
| D. | 一个氢气分子与一个氟气分子反应生成2个氟化氢气体分子放出270KJ热量 |
19.下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是( )
| A. | Na | B. | Na2O2 | C. | NaOH | D. | Fe |
9.能正确表示下列反应的离子方程式为( )
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| C. | 磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| D. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
16.下列实验结论正确的是( )
| A. | 向溶液中滴加BaCl2溶液产生白色沉淀再加稀盐酸沉淀不溶解,则证明原溶液中含有SO42- | |
| B. | 向溶液中加入稀盐酸,产生了能使澄清石灰水变浑浊的气体,则证明原溶液中含有CO32- | |
| C. | 向溶液中滴加NaOH溶液,并将湿润的红色石蕊试纸放在试管口发现试纸不变蓝,则证明原溶液中没有NH4+ | |
| D. | 向溶液中先滴加KSCN溶液不变色,后滴加氯水溶液变红,则证明原溶液中含有Fe2+ |
13.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
| A. | v(CO)=0.025 mol•L-1•S-1 | B. | v(NO2)=0.7 mol•L-1•min-1 | ||
| C. | v(N2)=0.36 mol•L-1•min-1 | D. | v(CO2)=1.1 mol•L-1•min-1 |
14.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | 牛奶 | B. | 鸡蛋清 | C. | 食盐水 | D. | 盐酸 |
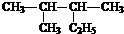 2,3-二甲基戊烷;
2,3-二甲基戊烷;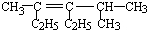 3,5-二甲基-4-乙基-3-己烯.
3,5-二甲基-4-乙基-3-己烯.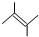 .
.